题目内容
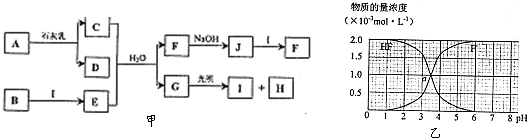
25℃时,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列叙述正确的是( )

| A.点①所示溶液:c(CH3COO-)+c(CH3COOH)=c(Na+) |
| B.点②所示溶液:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| C.点③所示溶液:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| D.滴定终点时:c(CH3COOH)+c(CH3COO-)=c(Na+) |

A.点①时,二者反应生成NaAc,还剩余等量的HAc,由物料守恒可知,c(CH3COO-)+c(CH3COOH)>c(Na+),故A错误;
B.点②时溶液pH=7,则c(H+)=c(OH-),由电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-),又显性离子大于隐性离子,则c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.点③时溶液的pH=8,等体积等浓度恰好完全反应,溶质为NaAc,醋酸根离子水解显碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.由图可知,点③附近达到滴定终点,但溶质可能为NaAc和NaOH,则c(CH3COOH)+c(CH3COO-)<c(Na+),故D错误;
故选B.
B.点②时溶液pH=7,则c(H+)=c(OH-),由电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)=c(CH3COO-),又显性离子大于隐性离子,则c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.点③时溶液的pH=8,等体积等浓度恰好完全反应,溶质为NaAc,醋酸根离子水解显碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.由图可知,点③附近达到滴定终点,但溶质可能为NaAc和NaOH,则c(CH3COOH)+c(CH3COO-)<c(Na+),故D错误;
故选B.

练习册系列答案
相关题目

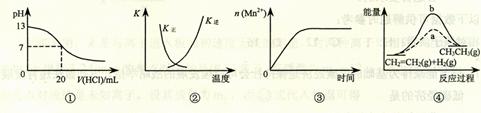

 2SO3(g);ΔH
< 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH
< 0 正、逆反应的平衡常数K随温度的变化 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化