题目内容
3.下列有关金属元素的叙述中正确的是( )| A. | 某金属元素从化合态变为游离态时,该元素一定发生还原反应 | |
| B. | 含金属元素的离子,一定都是阳离子 | |
| C. | 金属阳离子被还原一定得到金属单质 | |
| D. | 在氧化还原反应中,金属单质一定被还原 |
分析 A.某金属元素从化合态变为游离态时,金属元素的化合价降低;
B.含金属元素的离子,可能为阴离子;
C.金属阳离子被还原可能得到单质、也可能为离子;
D.金属在氧化还原中失去电子.
解答 解:A.某金属元素从化合态变为游离态时,金属元素的化合价降低,则得到电子被还原,发生还原反应,故A正确;
B.含金属元素的离子,可能为阴离子,如AlO2-等,故B错误;
C.金属阳离子被还原可能得到单质、也可能为离子,如Fe3+被还原生成Fe2+,Fe2+被还原生成Fe,故C错误;
D.金属在氧化还原中失去电子,则金属单质被氧化,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重分析与应用能力的考查,注意金属的性质及常见的实例,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
3.自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS).
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别和100mL物质的量为5mol/L的稀硝酸充分反应,所取样品质量与产生气体体积.(标准状况测定)如表所示:
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
(1)a实验结束后,溶液中c(NO3-)=2.75mol/L.
(2)b实验结束后,溶液的pH=0.
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别和100mL物质的量为5mol/L的稀硝酸充分反应,所取样品质量与产生气体体积.(标准状况测定)如表所示:
| 实验编号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
(1)a实验结束后,溶液中c(NO3-)=2.75mol/L.
(2)b实验结束后,溶液的pH=0.
14.下列各组物质的性质顺序,不正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
11.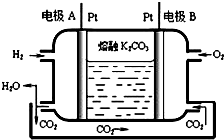 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:
(1)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10.处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)<c(HCN)(填“>”、“<”或“=”).
(2)已知:
①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)═Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).下表为该反应在不同温度时的平衡常数.
该反应的△H<0(填“>”、“<”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
(7)一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
 运用所学化学原理,解决下列问题:
运用所学化学原理,解决下列问题:(1)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸,已知:Ka(HCN)=6.17x10-10.处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)<c(HCN)(填“>”、“<”或“=”).
(2)已知:
①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)═Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g).下表为该反应在不同温度时的平衡常数.
| 温度/ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(7)一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
8.已知C-C单键可以绕键轴旋转,某烃的结构简式如图,下列说法中正确的是( )
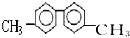

| A. | 该烃分子中最多有6个碳原子处于同一直线上 | |
| B. | 该烃分子中至少有10个碳原子处于同一平面上 | |
| C. | 该烃的一氯代物最多有四种 | |
| D. | 该烃是苯的同系物,能使酸性高锰酸钾溶液褪色 |
15.在下列变化过程中,被破坏的作用力正确的是( )
| A. | 冰融化一一共价键 | B. | 氢氧化钠熔融--离子键、共价键 | ||
| C. | 氯化氢溶于水--范德华力 | D. | 硫酸氢钠溶于水--离子键、共价键 |
12.化学用语是化学学科中最美的语言,下列有关化学用语使用不正确的是( )
| A. | 钙的元素符号:Ca | B. | 硫离子结构示意图: | ||
| C. | 二氧化碳的结构式 O=C=O | D. | NaCl的电子式: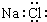 |
13.化合物的“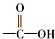 ”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
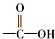 ”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )| A. | CHBr=CHCH3 | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
 X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:
X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题: