题目内容
(2010?临沂一模)下列各溶液中,微粒的物质的量浓度关系正确的是( )
分析:A.根据电荷守恒来计算;
B.10mL O.lmol/L的CH3COOH溶液与10mL 0.lmoL/L的NaOH溶液混合,恰好生成CH3COONa,从盐类的水解的角度分析;
C.pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合,酸过量,溶液呈酸性;
D.常温下,0.lmol/LpH=8的NaHB溶液中,HB-水解程度大于电离程度.
B.10mL O.lmol/L的CH3COOH溶液与10mL 0.lmoL/L的NaOH溶液混合,恰好生成CH3COONa,从盐类的水解的角度分析;
C.pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合,酸过量,溶液呈酸性;
D.常温下,0.lmol/LpH=8的NaHB溶液中,HB-水解程度大于电离程度.
解答:解:A.NaA溶液中的电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,故A正确
B.10mL O.lmol/L的CH3COOH溶液与10mL 0.lmoL/L的NaOH溶液混合,恰好生成CH3COONa,由于CH3COO-水解的程度较小,则有c(CH3COO-)>c(OH-),故B错误;
C.pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合,酸过量,溶液呈酸性,c(Na+)>c(CH3COO-)>(H+)>c(OH-),故C错误;
D.常温下,0.lmol/LpH=8的NaHB溶液中,HB-水解程度大于电离程度,则有c(H2B)>c(B2-),故D错误.
故选A.
B.10mL O.lmol/L的CH3COOH溶液与10mL 0.lmoL/L的NaOH溶液混合,恰好生成CH3COONa,由于CH3COO-水解的程度较小,则有c(CH3COO-)>c(OH-),故B错误;
C.pH=l的CH3COOH溶液与pH=13的NaOH溶液等体积混合,酸过量,溶液呈酸性,c(Na+)>c(CH3COO-)>(H+)>c(OH-),故C错误;
D.常温下,0.lmol/LpH=8的NaHB溶液中,HB-水解程度大于电离程度,则有c(H2B)>c(B2-),故D错误.
故选A.
点评:本题考查离子浓度的大小比较,题目难度较大,本题注意考虑弱电解质的电离和盐类水解的原理和应用,注意电荷守恒的应用.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
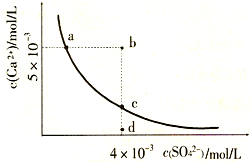 (2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
(2010?临沂一模)常温下,Ksp(CaS04)=9×l0-6,常温下CaS04在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
 (2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(2010?临沂一模)某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: