جâؤ؟ؤعبف
،¾جâؤ؟،؟îـثلﮣ¨LiCoO2£©µç³طتاز»ضضس¦سأ¹م·؛µؤذآذحµçش´£¬µç³طضذ؛¬سذةظء؟µؤآء،¢جْ،¢ج¼µبµ¥ضت،£تµرéتز³¢تش¶ش·د¾ةîـثل﮵ç³ط»طتصشظہûسأ،£تµرé¹³جبçدآ£؛
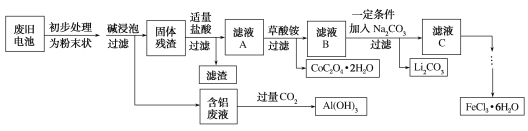
زرضھ£؛¢ظ»¹شذش£؛Cl£>Co2£«£»
¢عFe3£«؛ح![]() ½ل؛دةْ³ة½دخب¶¨µؤ[Fe£¨C2O4£©3]3££¬شعا؟ثلذشجُ¼دآ·ض½âضطذآةْ³ةFe3£«،£»ط´ًدآءذختجâ£؛
½ل؛دةْ³ة½دخب¶¨µؤ[Fe£¨C2O4£©3]3££¬شعا؟ثلذشجُ¼دآ·ض½âضطذآةْ³ةFe3£«،£»ط´ًدآءذختجâ£؛
£¨1£©·د¾ةµç³ط³ُ²½´¦ہيخھ·غؤ©×´µؤؤ؟µؤتا________،£
£¨2£©´س؛¬آء·دز؛µأµ½Al£¨OH£©3µؤہë×س·½³جت½خھ___________
£¨3£©آثز؛Aضذµؤبـضت³HCl،¢LiClح⻹سذ________£¨جر§ت½£©،£ذ´³ِLiCoO2؛حرخثل·´س¦µؤ»¯ر§·½³جت½____________
£¨4£©آثشüµؤض÷زھ³ة·ضخھ_______£¨جر§ت½£©،£
£¨5£©شع؟صئّضذ¼سببز»¶¨ضتء؟µؤCoC2O4،¤2H2O¹ججهرùئ·ت±£¬ئن¹ججهت§ضطآتت¾ف¼ûدآ±ي£¬اë²¹³نحêصû±يضذختجâ،£
زرضھ£؛¢ظCoC2O4شع؟صئّضذ¼سببت±µؤئّجه²ْخïخھCO2،£
¢ع¹ججهت§ضطآت£½¶شس¦خآ¶بدآرùئ·ت§ضطµؤضتء؟/رùئ·µؤ³ُت¼ضتء؟،£
ذٍ؛إ | خآ¶ب·¶خ§/،و | »¯ر§·½³جت½ | ¹ججهت§ضطآت |
¢ٌ | 120،«220 | CoC2O4،¤2H2O CoC2O4£«2H2O | 19.67% |
¢ٍ | 300،«350 | ______ | 59.02% |
£¨6£©زرضھLi2CO3µؤبـ¶ب»³£تKsp£½8.64،ء10£4£¬½«إ¨¶بخھ0.02 mol،¤L£1µؤLi2SO4؛حإ¨¶بخھ0.02 mol،¤L£1µؤNa2CO3بـز؛µبجه»»ى؛د£¬شٍبـز؛ضذµؤLi£«إ¨¶بخھ________ mol،¤L£1،£
،¾´ً°¸،؟شِ´َ½س´¥أو»£¬¼س؟ى·´س¦ثظآت£¬جل¸ك½³ِآت AlO2-£«CO2£«2H2O=Al£¨OH£©3،£«HCO3- FeCl3،¢CoCl2 2LiCoO2£«8HCl=2CoCl2£«Cl2،ü£«4H2O£«2LiCl C 2CoC2O4£«O2![]() 2CoO£« 4CO2 0.02
2CoO£« 4CO2 0.02
،¾½âخِ،؟
(1)´س·´س¦خï³ت·غؤ©×´½س´¥أو»¼«´َ¶ش·´س¦µؤس°دىہ´»ط´ً£»
(2)ء÷³جح¼ضھ؛¬آء·دز؛³ت¼îذش£¬زٍ´ثتائ«آءثل¸ùبـز؛ضذح¨¹ء؟¶رُ»¯ج¼£¬ذ´µأµ½Al£¨OH£©3µؤہë×س·½³جت½£»
(3)آثز؛Aµؤ³ة·ض£¬´سµç³طثù؛¬µؤخïضتسëHCl·´س¦ہ´»ط´ً£¬µ±ب»زھإإ³زر×ھزئµ½¼îز؛ضذµؤآءشھثط£» LiCoO2؛حرخثل·´س¦µؤ»¯ر§·½³جت½£¬½ل؛دذإد¢إذ¶دتارُ»¯»¹ش·´س¦£¬°´رُ»¯»¹ش·´س¦¹وآةتéذ´£»
(4)آثشüµؤض÷زھ³ة·ضخھ·دµç³ط×ـ¼ب²»بـسعثلسض²»بـسع¼îµؤ³ة·ض£»
(5) ²¹³نحêصû±يضذختج⣬زھ´سثùجل¹©µؤذإد¢،¢ت¾ف£¬½ل؛دشھثطضتء؟تط؛م¶¨آة¼ئثمµأ³ِ£»
(6)ہë×سإ¨¶بµؤ¼ئثم£¬دبزھسأإ¨¶بتا؛حKSPµؤ¹طدµإذ¶دتا·ٌسذج¼ثل﮳ءµي£¬بçسذ³ءµي£¬½ل؛دت¾ف¼ئثم£¬بçأ»سذ³ءµي£¬شٍ¾حتا»ى؛دبـز؛ضذہë×سµؤإ¨¶ب£»
·د¾ةîـثلï®ؤّہë×سµç³طض÷زھ؛¬سذFe،¢Al،¢ج¼µؤµ¥ضت؛حLiCoO2£¬³ُ²½´¦ہي£¬¼س¼î½إف£¬آء؛ح¼îز؛·´س¦ةْ³ةئ«آءثلرخ؛حاâئّ£¬¹ججه²ذشüخھ£؛Fe،¢Cµؤµ¥ضت؛حLiCoO2£¬¼سرخثلFe+2H+=Fe2++H2،ü£¬2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2،ü+4H2O£¬²ذشüخھC£¬آثز؛AخھFe3+،¢Li+،¢Co3+،¢Cl-£¬¼سبë²فثل泥¬¹آث³ءµيخھCoC2O42H2O£¬آثز؛Bخھ£؛Fe3+،¢Li+،¢Cl-£¬¼سبëج¼ثلؤئ£¬·¢ةْµؤہë×س·´س¦خھ2Li++CO32-=Li2CO3،£¬آثز؛CخھFe3+،¢Cl-£¬¼سبëرُ»¯¼ء·ہض¹جْہë×س±»»¹ش£¬µأآب»¯جْبـز؛£»
(1)·د¾ةµç³ط³ُ²½´¦ہيخھ·غؤ©×´µؤؤ؟µؤتا£؛شِ´َ½س´¥أو»£¬¼س؟ى·´س¦ثظآت£¬جل¸ك½³ِآت£»
´ً°¸خھ£؛شِ´َ½س´¥أو»£¬¼س؟ى·´س¦ثظآت£¬جل¸ك½³ِآت£»
(2) ئ«آءثلؤئبـز؛ضذح¨بë¹ء؟¶رُ»¯ج¼·´س¦ةْ³ةاâرُ»¯آء³ءµي؛حج¼ثلاâؤئ£¬زٍ´ث´س؛¬آء·دز؛µأµ½Al(OH)3µؤہë×س·´س¦·½³جت½خھ£؛AlO2-£«CO2£«2H2O=Al£¨OH£©3،£«HCO3-£»
´ً°¸خھ£؛AlO2-£«CO2£«2H2O=Al£¨OH£©3،£«HCO3-£»
(3) LiCoO2ضذLiخھ+1¼غ£¬Coخھ+3¼غ£¬¾كسذرُ»¯ذش£¬HClضذ-1¼غµؤآب¾كسذ»¹شذش£¬دٍ¹ججه²ذشüضذ¼سبëرخثلت±£¬·¢ةْرُ»¯»¹ش·´س¦£¬Co£¨+3،ْ+2£©£¬Cl£¨-1،ْ0£©£¬·´س¦±يت¾خھ£؛2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2،ü+4H2O»ٍ2LiCoO2£«8HCl=2CoCl2£«Cl2،ü£«4H2O£«2LiCl£»£¬آثز؛AخھFe3+،¢Li+،¢Co3+،¢Cl-£¬¹تآثز؛AضذµؤبـضتخھHCl،¢LiCl،¢FeCl3،¢CoCl2£»
´ً°¸خھ£؛FeCl3،¢CoCl2£»2LiCoO2£«8HCl=2CoCl2£«Cl2،ü£«4H2O£«2LiCl£»
(4)ةدتِ·ضخِ؟ةضھ£¬آثشüµؤض÷زھ³ة·ضخھC£»
´ً°¸خھ£؛C£»
(5) شع؟صئّضذ¼سببز»¶¨ضتء؟µؤCoC2O4،¤2H2O¹ججهرùئ·ت±£¬ت×دبت§ب¥½ل¾§ث®£¬شع120،«220،وت±£¬¹ججهت§ضطآتخھ19.76%£¬ةْ³ة²ْخïخھCoC2O4£»
سة¢ظ؟ةضھ£¬شع120،«220،وت±£¬CoC2O4،¤2H2Oحêب«ت§ب¥½ل¾§ث®ةْ³ةCoC2O4£¬ب»؛َ¼جذّة¸كخآ¶ب¼سبب£¬شٍCoC2O4·ض½âةْ³ةرُ»¯خئن·ض½âت§ب¥µؤضتء؟خھ183g،ء59.02%=108g£¬ت£سàµؤضتء؟خھ183g-108g=75g£¬ةè²ْخïµؤ»¯ر§ت½خھCoOx£¬شٍ59+16x=75£¬½âµأx=1£¬شٍ»¯ر§ت½خھCoO£¬شٍ·´س¦·½³جت½خھ£؛2CoC2O4£«O2![]() 2CoO£« 4CO2£»
2CoO£« 4CO2£»
´ً°¸خھ£؛2CoC2O4£«O2![]() 2CoO£« 4CO
2CoO£« 4CO
(6) ½«إ¨¶بخھ0.02molL-1µؤLi2SO4؛حإ¨¶بخھ0.02molL-1µؤNa2CO3بـز؛µبجه»»ى؛د£¬»ى؛دث²¼نبـز؛ضذc(Li+) =0.02mol/L£¬c(CO32-) =0.01mol/L£¬¼ئثمإ¨¶بةج![]() =4،ء10-6<Ksp=8.64،ء10-4£¬خق³ءµيةْ³ة£¬شٍ´ثت±بـز؛ضذLi+إ¨¶بخھ0.02mol/L£»
=4،ء10-6<Ksp=8.64،ء10-4£¬خق³ءµيةْ³ة£¬شٍ´ثت±بـز؛ضذLi+إ¨¶بخھ0.02mol/L£»
´ً°¸خھ£؛0.02،£

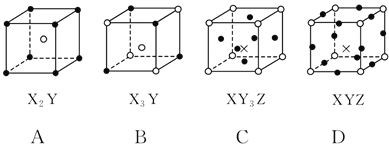
،¾جâؤ؟،؟¼×،¢ززتاء½ضض³£¼ûµؤ»¯؛دخX،¢Y،¢Zتابضض³£¼ûµؤµ¥ضت،£دآ±يثùءذ¸÷×éخïضتض®¼نح¨¹ز»²½·´س¦²»ؤـتµدضبçح¼ثùت¾×ھ»¯µؤتا£¨ £©
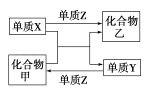
ر،دî | X | Y | Z | ¼× | زز |
A | C | H2 | O2 | H2O | CO |
B | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
C | Mg | C | O2 | CO2 | MgO |
D | H2 | Si | Cl2 | SiCl4 | HCl |
A.AB.BC.CD.D