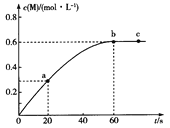
��Ŀ����
����Ŀ����ҵ�ϳ����ú����ˮ����![]() ��ʵ���ҿ�������װ��
��ʵ���ҿ�������װ��![]() ��ȥ���ּӳ�����
��ȥ���ּӳ�����![]() ģ�����ɹ��̣�
ģ�����ɹ��̣�
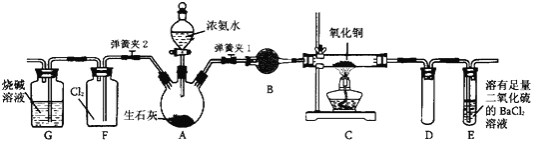
��ƿC�з�����Ӧ���£�
![]()
![]() ��
��![]()
![]()
![]() ��
��![]()
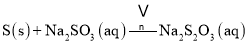
![]() ��
��![]()
(1)װ��A�з����Ļ�ѧ��Ӧ����ʽΪ ______
(2)Ϊ��߲�Ʒ���ȣ�Ӧʹ��ƿC��![]() ��
��![]() ǡ����ȫ��Ӧ������ƿC��
ǡ����ȫ��Ӧ������ƿC��![]() ��
��![]() ���ʵ���֮��Ϊ ______ ��
���ʵ���֮��Ϊ ______ ��
(3)װ��B������֮һ�ǹ۲�![]() ���������ʣ����е�Һ�����ѡ�� ______
���������ʣ����е�Һ�����ѡ�� ______
a.����ˮb.����![]() ��Һ c.����
��Һ c.����![]() ��Һd.����
��Һd.����![]() ��Һ
��Һ
ʵ���У�Ϊʹ![]() ����������ƿC�����õIJ����� ______ ��
����������ƿC�����õIJ����� ______ ��
(4)��֪��Ӧ![]() ��
��![]() ��Խ���������ƿC�з�Ӧ�ﵽ�յ�������� ______ ��װ��E������Ϊ ______
��Խ���������ƿC�з�Ӧ�ﵽ�յ�������� ______ ��װ��E������Ϊ ______
(5)��Ӧ��ֹ����ƿC�е���Һ������Ũ����������![]() �����п��ܺ���
�����п��ܺ���![]() ��
��![]() �����ʣ����������Լ����ʵ�飬����Ʒ���Ƿ����
�����ʣ����������Լ����ʵ�飬����Ʒ���Ƿ����![]() ����Ҫ˵��ʵ�����������ͽ��ۣ� ______ ��
����Ҫ˵��ʵ�����������ͽ��ۣ� ______ ��
��֪��![]() �����ֽ⣺
�����ֽ⣺![]() ��ѡ����Լ���ϡ���ᡢϡ���ᡢϡ���ᡢ
��ѡ����Լ���ϡ���ᡢϡ���ᡢϡ���ᡢ![]() ��Һ��
��Һ��![]() ��Һ��
��Һ��
���𰸡�![]() 2��1 c ���Ƶμ�������ٶ� ��Һ�����
2��1 c ���Ƶμ�������ٶ� ��Һ�����![]() �������ʧ
�������ʧ![]() ����
����![]() ��ֹ��Ⱦ���� ȡ������Ʒ��������ϡ�����У����ã�ȡ�ϲ���Һ
��ֹ��Ⱦ���� ȡ������Ʒ��������ϡ�����У����ã�ȡ�ϲ���Һ![]() ����˺�ȡ��Һ
����˺�ȡ��Һ![]() ���μ�
���μ�![]() ��Һ�������ְ�ɫ������˵������
��Һ�������ְ�ɫ������˵������![]() ����
����
��������
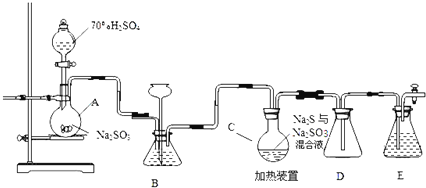
![]() ����װ��ͼ��֪��A�еķ�ӦΪŨ�������������Ʒ�Ӧ���ɶ�������
����װ��ͼ��֪��A�еķ�ӦΪŨ�������������Ʒ�Ӧ���ɶ�������
![]() ��
��![]() ��
��![]() ǡ����ȫ��Ӧ������ձ�C�еķ�Ӧ������
ǡ����ȫ��Ӧ������ձ�C�еķ�Ӧ������
![]() �۲�
�۲�![]() ���������ʣ�װ��B�е���Һ�������������ӦҲ�������ն�������ͨ�����Ƶμ�������ٶȣ����Կ��Ʋ���������������ʣ��ݴ˴��⣻
���������ʣ�װ��B�е���Һ�������������ӦҲ�������ն�������ͨ�����Ƶμ�������ٶȣ����Կ��Ʋ���������������ʣ��ݴ˴��⣻
![]() ����C�з����ķ�Ӧ��֪����ƿC�з�Ӧ�ﵽ�յ㷢���ķ�ӦΪ�����������Ʒ�Ӧ������������ƣ���Ӧβ������δ��Ӧ�Ķ����������壬����Ⱦ������
����C�з����ķ�Ӧ��֪����ƿC�з�Ӧ�ﵽ�յ㷢���ķ�ӦΪ�����������Ʒ�Ӧ������������ƣ���Ӧβ������δ��Ӧ�Ķ����������壬����Ⱦ������
![]() ����Ʒ���Ƿ����
����Ʒ���Ƿ����![]() ���ȼ������ų����ţ��������Ȼ���������������ӡ�
���ȼ������ų����ţ��������Ȼ���������������ӡ�
![]() ����װ��ͼ��֪��A�еķ�ӦΪŨ�������������Ʒ�Ӧ���ɶ�������Ӧ�Ļ�ѧ����ʽΪ��
����װ��ͼ��֪��A�еķ�ӦΪŨ�������������Ʒ�Ӧ���ɶ�������Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��
��![]() ��
��![]() ǡ����ȫ��Ӧ����
ǡ����ȫ��Ӧ����![]() ��
��![]()
![]() ��
��![]()
![]() ��
��![]()
��֪��![]() ��
��![]() ��
��![]() ��
��![]() ���õ��ܷ�ӦΪ
���õ��ܷ�ӦΪ ����C��
����C��![]() ��
��![]() ���ʵ���֮��Ϊ2��1��
���ʵ���֮��Ϊ2��1��
�ʴ�Ϊ��2��1��
![]() �۲�
�۲�![]() ���������ʣ�����ǿ����ȡ����ķ�Ӧ��a�����ɶ�������bd�����ʾ����������Ӧ��ֻ��c�б���
���������ʣ�����ǿ����ȡ����ķ�Ӧ��a�����ɶ�������bd�����ʾ����������Ӧ��ֻ��c�б���![]() ��Һ�ʺ���ȡ��������ͨ�����Ƶμ�������ٶȣ����Կ��Ʋ���������������ʣ�����Ϊʹ
��Һ�ʺ���ȡ��������ͨ�����Ƶμ�������ٶȣ����Կ��Ʋ���������������ʣ�����Ϊʹ![]() ����������ƿC�����õIJ����ǿ��Ƶμ�������ٶȣ�
����������ƿC�����õIJ����ǿ��Ƶμ�������ٶȣ�
�ʴ�Ϊ��c�����Ƶμ�������ٶȣ�
![]() ����C�з����ķ�Ӧ��֪����ƿC�з�Ӧ�ﵽ�յ㷢����ӦΪ�����������Ʒ�Ӧ������������ƣ���Ӧ������Ϊ��Һ�����
����C�з����ķ�Ӧ��֪����ƿC�з�Ӧ�ﵽ�յ㷢����ӦΪ�����������Ʒ�Ӧ������������ƣ���Ӧ������Ϊ��Һ�����![]() �������ʧ
�������ʧ![]() ����Ӧβ������δ��Ӧ�Ķ����������壬����Ⱦ����������Ҫ��Eװ������
����Ӧβ������δ��Ӧ�Ķ����������壬����Ⱦ����������Ҫ��Eװ������![]() ��ֹ��Ⱦ������
��ֹ��Ⱦ������
�ʴ�Ϊ����Һ�����![]() �������ʧ
�������ʧ![]() ������
������![]() ��ֹ��Ⱦ������
��ֹ��Ⱦ������
![]() ����Ʒ���Ƿ����
����Ʒ���Ƿ����![]() ������������ͽ���Ϊȡ������Ʒ��������ϡ�����У����ã�ȡ�ϲ���Һ
������������ͽ���Ϊȡ������Ʒ��������ϡ�����У����ã�ȡ�ϲ���Һ![]() ����˺�ȡ��Һ
����˺�ȡ��Һ![]() ���μ�
���μ�![]() ��Һ�������ְ�ɫ������˵������
��Һ�������ְ�ɫ������˵������![]() ���ʣ�
���ʣ�
�ʴ�Ϊ��ȡ������Ʒ��������ϡ�����У����ã�ȡ�ϲ���Һ![]() ����˺�ȡ��Һ
����˺�ȡ��Һ![]() ���μ�
���μ�![]() ��Һ�������ְ�ɫ������˵������
��Һ�������ְ�ɫ������˵������![]() ���ʡ�
���ʡ�