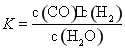题目内容
a mol FeS与b mol FeO投入到V L、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g ②(a+b)×189 g
③(a+b) mol ④[Vc-(9a+b)/3] mol
A.①④ B.②③ C.①③ D.②④
D
【解析】在此反应中硝酸分两部分参加反应即硝酸的总量=被还原的硝酸的量+未被还原的硝酸的量,由铁原子守恒和氮原子守恒可知n(未被还原的硝酸)=3n[Fe(NO3)3],m(未被还原的硝酸)=(a+b)×3×63=(a+b)×189 g;由得失电子相等可以求出被还原的硝酸的物质的量:a×(3-2)+a×[6-(-2)]+b×(3-2)=n(被还原的硝酸)×(5-2),n(被还原的硝酸)=(9a+b)/3 mol,n(未被还原的硝酸)=n(总硝酸)-n(被还原的硝酸)=[Vc-(9a+b)/3] mol,因此D选项正确。

练习册系列答案
相关题目