题目内容
关于下列各图的说法,正确的是
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中电子由b极流向a极 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
D
解析试题分析:电解池中阳离子移向阴极,氧化性较强的Cu2+优先发生还原反应,则阴极上析出单质铜,故A错误;根据电解原理,电镀池中待镀铁制品作阴极,与直流电源的负极相连,故B错误;燃料电池中通入燃料的电极为负极,通入氧气的电极为正极,负极流出电子,正极流入电子,则外电路中电子从a极经过导线流向b极,故C错误;电解饱和食盐水时,阳极反应式为2Clˉ-2eˉ=Cl2↑,阴极反应式为2H2O+2eˉ=H2↑+2OHˉ,离子交换膜可以使OHˉ与Cl2隔离,防止二者之间发生氧化还原反应,故D正确。
考点:考查电化学,涉及电解氯化铜溶液、铁上镀铜、氢氧燃料电池、电解饱和食盐水等。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
下列条件下钢铁不易被腐蚀的是:
| A.电解食盐水铁做阴极 |
| B.酸雨 |
| C.镀锡铁镀层被破坏 |
| D.潮湿空气 |
电解尿素[ CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。下列说法正确的是
| A.电解时,b极是阴极放出H2,发生氧化反应 |
| B.溶液中OH—逐渐向b极移动 |
C.电解时,a极的电极反应式为: |
| D.若在b极产生标况下224mL氢气,则消耗尿素2g |
控制适当的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
| A.反应开始时,乙中电极反应为2I--2e-= I2 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.平衡时甲中溶入FeCl2固体后,电流计读数为零 |
下列叙述正确的是
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 |
| C.上图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| D.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为:O2+4H++4e-=2H2O |
下列实验现象预测正确的是
| A.实验I:电流表A指针偏转,碳棒上有红色固体析出 |
| B.实验II:电流表A指针偏转,铁极上有无色气体产生 |
| C.实验III:碳棒上有无色气体产生,铁极上有黄绿色气体产生 |
| D.实验IV:粗铜溶解,精铜上有红色固体析出 |
下列叙述正确的是
| A.用饱和NaHCO3溶液可以将混在CO2气体中的HCl除去 |
| B.能使润湿的淀粉KI试纸变蓝的气体一定是Cl2 |
| C.某“海水”电池的总反应为:5MnO2+2Ag+2NaCl==Na2Mn5O10+2AgCl,每生成1 mol Na2Mn5O10转移2 mol电子 |
| D.在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来.下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.该电池工作时,有关说法正确的是 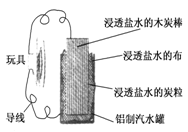
| A.炭棒应与玩具电机的负极相连 |
| B.炭粒和炭棒上发生的反应为:O2+4e-=2O2- |
| C.铝罐将逐渐被腐蚀 |
| D.该电池工作一段时间后炭棒和炭粒的质量会减轻 |