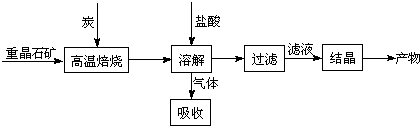
题目内容
工业上制备H2的一种重要方法是:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=Q kJ?mol1
CO2(g)+H2(g) △H=Q kJ?mol1
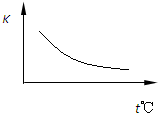
已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L1)随时间的变化关系如下表:

| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
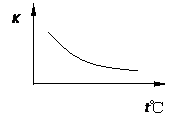
(2)Q 0(填“>”、“=”或“<”=。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
(4)上表中c2为 mol?L=1,CO(g)的转化率为 。
(1)C
(2)<
(3)不变 提高CO的转化率或利用率
(4)0.18 60%

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案工业上制备H2的一种重要方法是:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
CO2(g)+H2(g) △H=Q kJ·mol―1。已知该反应的平衡常数K与温度的关系如图所示。若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol·L―1)随时间的变化关系如下表:
|
| CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)下列可以判断该反应达到化学平衡状态的是 。
A.单位时间内减少CO(g)的浓度等于生成CO2(g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中H2(g)的浓度不再发生改变
D.氢气的生成速率等于水的消耗速率
(2)Q 0(填“>”、“=”或“<”)。
(3)若在850℃时向反应容器中充入H2O(g),K值 (填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值 。
(4)上表中c2为 mol·L=1,CO(g)的转化率为 。
 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ?mol-1.已知该反应的平衡常数K与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2(g)+H2(g)△H=Q kJ?mol-1.已知该反应的平衡常数K与温度的关系如图所示.若在一固定的密闭容器中,850℃时发生上述反应,并测得容器内各物质的浓度(mol?L-1)随时间的变化关系如下表:
 时间/min
时间/min