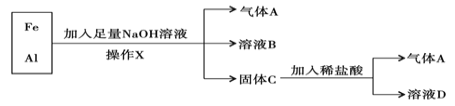
题目内容
【题目】电化学原理具有极为广泛的应用,请回答下列问题:
(1)电镀是防止金属腐蚀的重要方法,铁制品表面上镀铜的装置示意图如图所示:
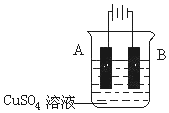
①A电极对应的金属是__________(写元素名称)。
②电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为a g,则电镀时电路中通过的电子为_________mol。
(2)工业上常用电解熔融氯化镁获得金属镁,若电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率,写出生成MgO 的化学方程式_________________。
(3)“镁-次氯酸盐”燃料电池的装置如图所示:
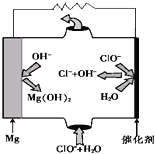
①该电池的正极反应式为__________________。
②若用该电池为电源,用惰性电极电解CuSO4溶液,电解一段时间后,向电解液中加入0.1mol Cu2(OH)2CO3,恰好使溶液恢复到电解前的浓度和pH。电解过程产生的气体体积(在标准状况下)为____________。
【答案】铜a/642MgOHCl+Mg=2MgO+MgCl2+H2↑ClO-+2e-+H2O=Cl-+2OH-5.6L
【解析】
(1)①在铁上镀铜时,铜作阳极连接原电池正极,铁作阴极连接原电池负极,所以A为铜,B为铁,铁电极上铜离子得电子生成铜单质,电极反应式为Cu2++2e-═Cu,故答案为:铜;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,所以阴极上析出铜的质量=ag×![]() =
=![]() g,转移电子的物质的量=
g,转移电子的物质的量=![]() ×2=
×2=![]() mol,故答案为:
mol,故答案为:![]() ;
;
(2)生成的MgOHCl与阴极产生的Mg反应生成MgO,氯化镁和氢气,反应的化学方程式为:2MgOHCl+Mg=2MgO+MgCl2+H2↑,故答案为:2MgOHCl+Mg=2MgO+MgCl2+H2↑;
(3)①根据“镁-次氯酸盐”燃料电池的装置图中微粒变化可知,ClO-在正极放电,生成Cl-,结合碱性的环境,正极反应式:ClO-+2e-+H2O=Cl-+2OH-,故答案为:ClO-+2e-+H2O=Cl-+2OH-;
②电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:第一阶段2CuSO4+2H2O![]() 2Cu↓+O2↑+2H2SO4,第二阶段:2H2O
2Cu↓+O2↑+2H2SO4,第二阶段:2H2O![]() 2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuOH2OCO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,加入0.2molCuO说明电解放出了0.1mol氧气,电解0.1mol水生成0.1mol氢气和0.05mol氧气,共生成气体0.1mol+0.1mol+0.05mol=0.25mol,气体在标准状况下的体积=0.25mol×22.4L/mol=5.6L,故答案为:5.6L。
2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuOH2OCO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,加入0.2molCuO说明电解放出了0.1mol氧气,电解0.1mol水生成0.1mol氢气和0.05mol氧气,共生成气体0.1mol+0.1mol+0.05mol=0.25mol,气体在标准状况下的体积=0.25mol×22.4L/mol=5.6L,故答案为:5.6L。

【题目】甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g) +CO2 (g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______。
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=_______。
(3)500℃时测得反应在某时刻,H2(g)、CO2(g)、CH3OH(g)H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时V正____V逆(填“>”“=”“<”)。
(4)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示,若开始加入2mol/LH2和1mol./LCO,则B点时化学平衡常数为___________。

(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如下表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为_______,乙中CO2的转化率____甲。(填“大 于”、“等 于”或“小于”)
起始浓度 | 甲 | 乙 |
c(H2)/mol/L | 0.10 | 0.20 |
c(CO2 )/mol/L 0.10 | 0.20 |