题目内容
【题目】已知A、B、C、D、E、F是含有同一种元素的化合物,其中F能使湿润红色石蕊试纸变蓝色,它们之间能发生如下反应:
①A+H2O→B+C ②C+F→D ③D+NaOH→F+E+H2O
(1)写出B的化学式_________。
(2)工业生产C的过程中有如下一步反应:即F经催化氧化生成B和H2O,写出该步反应的化学方程式:____________________________。
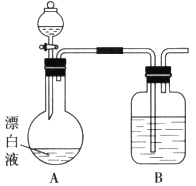
(3)某同学用图示装置(固定、加热仪器和橡胶管略)进行有关F的制取实验探究,回答下列问题:

(i)若用装置①制取F,其收集装置为__________(填装置序号),发生反应的化学方程式为______________________。
(ⅱ)若用装置②制取F,分液漏斗中盛装的试剂为__________,圆底烧瓶中盛装的试剂为______________。(任写一种)
【答案】 NO ![]() ⑥
⑥ ![]() 浓氨水 碱石灰 或 CaO 或 NaOH固体
浓氨水 碱石灰 或 CaO 或 NaOH固体
【解析】本题考查无机推断,F能使湿润的红色石蕊试纸变蓝,因此F为NH3,根据③,推出D为铵盐,因为它们含有同一种元素,因此D为NH4NO3,即E为NaNO3,根据③,可以推出②中C为HNO3,则A为NO2,B为NO,(1)根据上述分析,B为NO;(2)制备硝酸,利用NH3的催化氧化,生成NO和H2O,因此反应方程式为4NH3+5O2 ![]() 4NO+6H2O;(3)(i)NH3的密度小于空气,极易溶于水,因此采用向下排空气法收集,导管需要伸入到试管的底部,故⑥正确;装置①制备NH3,利用固体+固体反应生成气体,药品是NH4Cl和Ca(OH)2,反应方程式为2NH4Cl+Ca(OH)2
4NO+6H2O;(3)(i)NH3的密度小于空气,极易溶于水,因此采用向下排空气法收集,导管需要伸入到试管的底部,故⑥正确;装置①制备NH3,利用固体+固体反应生成气体,药品是NH4Cl和Ca(OH)2,反应方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O;(ii)用装置②制取NH3,利用固体+液体,利用NH3·H2O不稳定,受热易分解,固体应是与水放热的,可以是CaO、NaOH等,分液漏斗应盛放氨水。
CaCl2+2NH3↑+2H2O;(ii)用装置②制取NH3,利用固体+液体,利用NH3·H2O不稳定,受热易分解,固体应是与水放热的,可以是CaO、NaOH等,分液漏斗应盛放氨水。

【题目】下列有关性质的比较,不能用元素周期律解释的是( )
A. 酸性:H2SO4>H3PO4 B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2 D. 热稳定性:Na2CO3>NaHCO3
【题目】(15分)I.短周期元素X、Y、Z在元素周期表中的位置如下图所示,其中Y元素原子的最外层电子数是电子层数的两倍。回答下列问题:
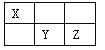
(1)Y元素在元素周期表中的位置是 。
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: 。
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐。该盐溶液的pH 7(填“<”、“>”或“=”),其原因为(用离子方程式表示) 。
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键。该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体。该反应的化学方程式为 。
II.已知可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),平衡常数见下表:
CO2(g)+H2(g),平衡常数见下表:
温度/℃ | 500 | 700 | 850 | 1 000 |
平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
(5)该反应ΔH 0(填“<”或“>”)。
(6)850 ℃时,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 molCO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件是 。
若x=5.0,当反应达到平衡时,n(H2)= 。