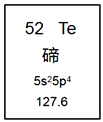
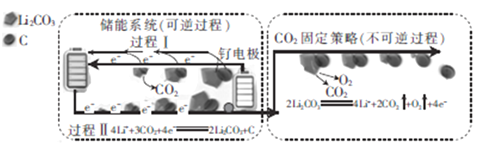
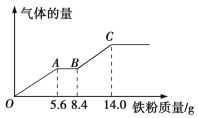
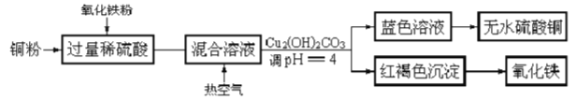
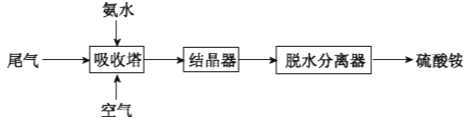
题目内容
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为: CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)T℃时,在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
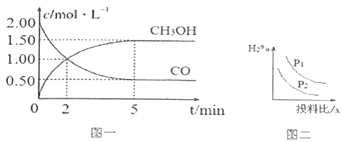
①反应2min到5min,用氢气表示的平均反应速率v(H2)=___________。
②下列说法正确的是______________(填字母序号)。
A.达到平衡时,CO的转化率为50%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
E.加入催化剂可以加快化学反应速率,同时提高 CO和H2平衡的转化率
③下列叙述可以说明该反应在该条件下已经达到化学平衡的是:______(填字母序号)。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=2v(H2)逆D.n(CO)与n(H2)的比值不变
(2)某温度下,在一容积可变的恒压密闭容器中分别充入1molCO和1.2molH2,达到平衡时容器体积为2L,且含有0.5molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.3molCO和0.3molCH3OH(g),则此平衡将______________移动。(填“向正反应方向”、“不”或“向逆反应方向”)
(3)若压强、投料比x=n(CO)/n(H2)对反应的影响如图二所示,则图中曲线所示的压强关系:p1_____p2(填“=”“>”或“<”)。
(4)工业上另一种合成甲醇的方法是利用CO2和H2,己知:CH3OH、H2的燃烧热(ΔH)分别为-726.9kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH(l)和H2O(l)的热化学方程式______________________________________________。
【答案】1/3mol/(Lmin) B B 100 向逆反应方向 < CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-130.5kJ/mol
【解析】
(1)① 反应2min到5min,甲醇的浓度变化量为1.5-1=0.5mol/L,v(CH3OH)=0.5/(5-2)=1/6 mol/(Lmin),根据速率之比和系数成正比关系可知,v(H2)=2 v(CH3OH)=1/3mol/(Lmin);综上所述,本题答案是:1/3mol/(Lmin)。
②A.结合三段式可知:设CO的消耗量为xmol,
CO(g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 2 4 0
变化量 x 2x x
平衡量 2-x 4-2x x
根据图像可知:2-x=0.5,x=1.5 mol;达到平衡时,CO的转化率为1.5/2×100%=75% ,错误;
B.5min后反应达到平衡,该反应是一个气体体积减小的反应,当容器中压强不再改变时,反应达到平衡状态,正确;
C.恒温恒容条件下,达到平衡后,再充入氩气,总压增大分压不变,速率不变,错误;
D.2min前后,反应未达到平衡状态,反应正向进行,v(正)![]() (逆),故D错误;
(逆),故D错误;
E.加入催化剂可以加快化学反应速率,但是平衡不移动,不能提高 CO和H2平衡的转化率,错误;
综上所述,本题选B。
③A.反应前后混合气体的质量不变,容器的体积不变,所以混合气体的密度不发生改变 ,恒为定值,不能判定反应达到平衡状态,错误;
B. 反应前后混合气体的质量不变,反应向右混合气体的总量减小,因此混合气体的平均相对分子质量不再发生改变时,反应达到平衡状态,正确;
C. 正逆反应的速率比等于系数比一定达到平衡状态,所以v(CO)正=2v(H2)逆不一定平衡,错误;
D. 根据(A)可知n(CO):n(H2)=(2-x):(4-2x)=1:2,所以n(CO)与n(H2)比值是定量,定量不变不一定平衡,错误;
综上所述,本题选B。
(2) CO(g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 1 1.2 0
转化 0.5 1 0.5
平衡 0.5 0.2 0.5
平衡时各物质浓度为:c(CO)=0.5/2=0.25mol/L c(H2)= 0.2/2=0.1 mol/L, c(CH3OH )=0.5/2=0.25mol/L, 则该反应平衡常数的值为0.25/(0.25×0.12)=100;此时向容器中再通入0.3molCO和0.3mo1CH3OH(g),容器的体积变为1.8×2/1.2=3L,Q=(0.8/3)/[(0.8/3)×(0.2/3)2]>100,所以此平衡将逆向移动;综上所述,本题答案是:100,向逆反应方向。
(3)增大压强平衡正向移动,氢气的百分含量降低,所以p1<p2;综上所述,本题答案是:<。
(4)CH3OH、H2的燃烧热(△H)分別为-726.9kJ/mol、-285.8kJ/mol,则①CH3OH(l)+3/2 O2(g)=CO2(g)+ 2H2O(l) ΔH=--726.9kJ/mol;②H2(g)+1/2 O2(g)= H2O(l) ΔH= -285.8kJ/mol,根据盖斯定律②×3-① ,得CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-130.5kJ/mol;综上所述,本题答案是:CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-130.5kJ/mol。

【题目】许多非金属元素是重要的化工原料,某学习小组对某些非金属的化合物性质和制备进行如下实验探究:
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析
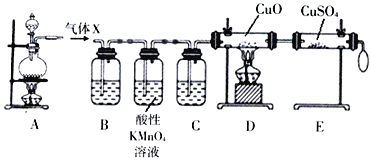
回答下列问题:
(1)气体X可能是________。(水蒸气除外)
(2)酸性高锰酸钾溶液的作用是________
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是____、______。
Ⅱ.下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及A中酒精灯已略)。
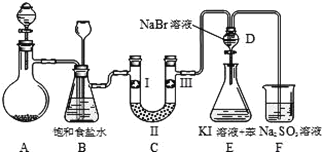
(1)实验室制氯气的离子方程式为________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
【题目】如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )

选项 | X | 收集气体 | Y |
A | 碱石灰 | 氯气 | 氢氧化钠 |
B | 碱石灰 | 氯化氢 | 氢氧化钠 |
C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
A. AB. BC. CD. D