题目内容
18.在化学方程式上用双线桥法标电子转移的方向和数目,并填空.(1)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
被氧化的元素是O,被还原元素是Cl(填元素符号).
(2)3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O氧化剂与还原剂物质的量之比是2:1.
分析 (1)反应2KClO3═2KCl+3O2↑中Cl元素的化合价由+5价降低为-1价,O元素的化合价由-2价升高为0,以此解答该题;
(2)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中失电子的元素是铜元素,化合价升高,则铜为还原剂,得电子的元素是氮元素,化合价降低,则氧化剂为硝酸,化合价降低数目=化合价升高数目=转移的电子数目.
解答 解:(1)Cl元素的化合价由+5价降低为-1价降低被还原,O元素的化合价由-2价升高为0升高被氧化,电子转移方向与数目为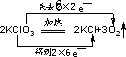 ,
,
故答案为: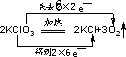 ,O;Cl;
,O;Cl;
(2)氧化还原反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中失电子的元素是铜元素,化合价升高,则铜为还原剂,得电子的元素是氮元素,化合价降低,则氧化剂为硝酸,并且8mol硝酸参加反应2mol作氧化剂,转移的电子数目为6mol,电子转移情况为: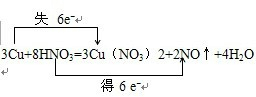 ,所以氧化剂与还原剂物质的量之比是2:1;故答案为:
,所以氧化剂与还原剂物质的量之比是2:1;故答案为: ;2:1.
;2:1.
点评 本题考查氧化还原反应,注意电子、电荷守恒为解答的关键,注意双线桥表示电子转移方向与数目,明确发生的化学反应为解答的关键,题目难度不大

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
8.化学与科学发展、生产、生活密切相关.下列有关说法中错误的是( )
| A. | “碳纳米泡沫”被称为第五形态的单质碳,与石墨互为同素异形体 | |
| B. | “神七”飞船返回仓的绝热层所使用的是耐高温、抗氧化的新型材料 | |
| C. | 卫生部公布的首批非法食品添加剂中的三聚氰胺是一种含氮量很高的蛋白质 | |
| D. | 陶瓷、玻璃、水泥是使用量最大的无机非金属材料,都属于硅酸盐产品 |
9.同一物质中同一价态的元素部分被氧化、部分被还原的氧化还原反应是( )
| A. | 2KNO3$\frac{\underline{\;\;△\;\;}}{\;}$2KNO2+O2↑ | B. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | SO2+2H2S═3S↓+2H2O |
13. 在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.
在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.
(1)在0~4min内生成O2的平均速率v(O2)=0.0025 mol/(L•min).
(2)整个过程中,各物质的浓度与时间的关系如图所示,则该温度下的平衡常数K=0.4.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L的是BD,此时的平衡常数与(2)中相比相等(填“增大”、“减小”或“不变”).
 在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.
在20L的恒容密闭容器中,加入3mol SO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,反应至8min时达平衡状态.(1)在0~4min内生成O2的平均速率v(O2)=0.0025 mol/(L•min).
(2)整个过程中,各物质的浓度与时间的关系如图所示,则该温度下的平衡常数K=0.4.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L的是BD,此时的平衡常数与(2)中相比相等(填“增大”、“减小”或“不变”).
| 选项 | A | B | C | D |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
10.下列叙述正确的是( )
| A. | Na202在潮湿的空气中放置一段时间,变成白色贴稠物的原因是2Na202+2CO2=2Na2CO3+O2 | |
| B. | Na202用作呼吸面具中的供氧剂,不涉及氧化还原反应 | |
| C. | 常温常压下,Na202与足量H2O反应生成0.2mol O2时,转移的电子为0.2mol | |
| D. | 将钠放在空气中的变化过程为Na→Na2O→Na0H→Na2CO3•10H2O→Na2CO3 |
7.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如如图1

已知:
①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成CoCl2.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发(浓缩)、冷却(结晶)和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图3所示).若该电池的总反应为$?_{放电}^{充电}$LiCoO2+C6?CoO2+LiC6,则电池放电时的正极反应式为CoO2+Li++e-=LiCoO2.

已知:
①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发(浓缩)、冷却(结晶)和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中(如图3所示).若该电池的总反应为$?_{放电}^{充电}$LiCoO2+C6?CoO2+LiC6,则电池放电时的正极反应式为CoO2+Li++e-=LiCoO2.
 有机物A可由葡萄糖发酵得到.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验.
有机物A可由葡萄糖发酵得到.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验. .
.