题目内容
磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是 .
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有 mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I-2S2O
+I2═S4O
+2I-在一定体积的某维生素C溶液中加入a mol?L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol?L-1Na2S2O3溶液V2 mL.该溶液中维生素C的物质的量是 mol.
(1)磷元素的原子结构示意图是
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I-2S2O
2- 3 |
2- 6 |
分析:(1)P原子核外有15个电子,有3个电子层,最外层有5个电子;
(2)根据白磷和转移电子之间的关系式计算;
(3)根据氧化还原反应中得失电子数相等进行计算.
(2)根据白磷和转移电子之间的关系式计算;
(3)根据氧化还原反应中得失电子数相等进行计算.
解答:解:(1)P原子核外有15个电子,有3个电子层,最外层有5个电子,所以P原子结构示意图为 ,
,
故答案为: ;
;
(2)2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 ①
10C+P4O10═P4+10CO ②
将方程式①+②得2Ca3(PO4)2+6SiO2+10C=6CaSiO3+P4+10CO,根据磷元素和转移电子之间的关系式得,每生成1mol P4得到电子的物质的量=1mol×4×(5-0)=20mol,
故答案为:20mol;
(3)氧化还原反应中得失电子相等,由题目给出的两个离子方程式知,n(I2)=n(C6H8O6)+0.5n(S2O32- ),
即aV1×10-3=n(C6H8O6)+0.5bV2×10-3,则n(C6H8O6)=aV1×10-3-0.5bV2×10-3=
,
故答案为:
.
 ,
,故答案为:
 ;
;(2)2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 ①
10C+P4O10═P4+10CO ②
将方程式①+②得2Ca3(PO4)2+6SiO2+10C=6CaSiO3+P4+10CO,根据磷元素和转移电子之间的关系式得,每生成1mol P4得到电子的物质的量=1mol×4×(5-0)=20mol,
故答案为:20mol;
(3)氧化还原反应中得失电子相等,由题目给出的两个离子方程式知,n(I2)=n(C6H8O6)+0.5n(S2O32- ),
即aV1×10-3=n(C6H8O6)+0.5bV2×10-3,则n(C6H8O6)=aV1×10-3-0.5bV2×10-3=
| aV1-0.5bV2 |
| 1000 |
故答案为:
| aV1-0.5bV2 |
| 1000 |
点评:本题考查了氧化还原反应物质的量的计算,根据氧化还原反应中得失电子性质、还原产物和转移电子之间的关系式来分析解答即可,难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目


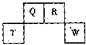 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

 ______ML。
______ML。