题目内容
【题目】碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:
(1)已知下列热化学方程式:
i. CH2=CHCH3(g)+ Cl2(g)=CH2ClCHClCH3(g) △H1= -133 kJ·mol-1
ii. CH2=CHCH3(g)+Cl2(g)=CH2 =CHCH2Cl(g)+HCl(g) △H2= -100 kJ·mol-1
又已知在相同条件下,CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g) 的正反应的活化能Ea(正)为132 kJmol-1,则逆反应的活化能Ea(逆)为________kJmol-1。
(2)查阅资料得知,反应CH3CHO(aq)=CH4(g)+CO(g)在含有少量I2的溶液中分两步进行:
第I步反应为CH3CHO(aq)+I2(aq)→CH3I(l) +HI(aq)+CO(g)(慢反应);
第II步为快反应。增大I2的浓度________(填“能”或“ 不能”)明显增大总反应的平均速率,理由为______________。
(3)用催化剂Fe3(CO)12/ZSM -5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。

欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM -5中添加__________助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是__________________。
(4)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4) =2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:
CS2(g)+4H2(g)。0. 11MPa时,温度变化对平衡时产物的物质的量分数的影响如下图所示:

为提高H2S的平衡转化率,除改变温度外,还可采取的措施是______________(列举一条)。N点对应温度下,该反应的Kp=______ ( MPa)2(Kp为以分压表示的平衡常数)。
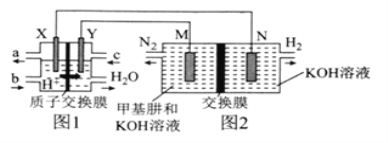
(5)合成碳酸二甲酯的工作原理如下图所示。

阳极的电极反应式为_______,离子交换膜a为__________(填“阳膜”、“阴膜”)。
【答案】165 能 总反应的平均速率由慢反应决定,I2 为慢反应的反应物,增大I2的浓度,慢反应的反应速率增大,则总反应的反应速率增大(或根据总反应可知I2可为该反应的催化剂,增大I2的浓度,可以增大总反应的平均反应速率) K 降低生成乙烯的反应所需要的活化能,加快乙烯生成速率,而对其他副反应几乎无影响 减小体系压强,或及时分离出产物,或减小起始时![]() 等(任写一条) 8×10-4 2CH3OH+CO-2e-=(CH3O)2CO+2H+ 阳膜
等(任写一条) 8×10-4 2CH3OH+CO-2e-=(CH3O)2CO+2H+ 阳膜
【解析】
(1)i.CH2=CHCH3(g)+Cl2(g)=CH2ClCHClCH3(g) △H1= -133 kJ·mol-1
ii.CH2=CHCH3(g)+Cl2(g)=CH2=CHCH2Cl(g)+HCl(g) △H2= -100 kJ·mol-1
根据盖斯定律,将i-ii得CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g),△H=Ea(正)-Ea(逆);
(2)第II步反应可由总反应-第I步反应得到,总反应的平均速率由慢反应决定,根据增大I2的浓度对反应速率的影响分析,或从催化剂的角度分析;
(3)由表中数据,兼顾乙烯的产率、CO2转化率和对副反应的影响,选择添加K助剂效果最好,其他副反应占比少,根本原因是降低反应的活化能、加快乙烯生成速率;
(4)根据图示,升高温度,CH4的物质的量分数减小,说明升高温度,平衡正移;为提高H2S的平衡转化率,即平衡正移,除改变温度外,还可减小体系压强、及时分离出产物、减小起始时![]() 等;N点时,n(H2S)%=n(H2)%,设起始加入甲烷物质的量为3mol,转化甲烷物质的量为xmol,列“三段式”:
等;N点时,n(H2S)%=n(H2)%,设起始加入甲烷物质的量为3mol,转化甲烷物质的量为xmol,列“三段式”:
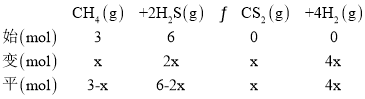
6-2x=4x,解出x,平衡常数KP= ;
;
(5)该装置为电解池,根据图示,O2在电极表面转化为H2O,氧元素的化合价降低,得电子,发生还原反应,则通入氧气的一极为阴极,电源电极B为负极,A为正极,故通入一氧化碳和甲醇的一极为阳极,阳极的电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+,阴极的电极反应为:O2+4H++4e-=2H2O,据此分析解答。
(1)已知:i. CH2=CHCH3(g)+C12(g)=CH2ClCHClCH3(g) △H1= -133 kJ·mol-1
ii. CH2=CHCH3(g)+Cl2(g)=CH2 =CHCH2Cl(g)+HCl(g) △H2= -100 kJ·mol-1
根据盖斯定律,将i-ii得CH2=CHCH2Cl(g)+HCl(g)=CH2ClCHClCH3(g) △H=-133 kJ·mol-1-(-100 kJ·mol-1)=-33 kJ·mol-1,△H=Ea(正)-Ea(逆),则逆反应的活化能Ea(逆)为132 kJmol-1+33 kJ·mol-1=165 kJ·mol-1;
(2)根据题意,第II步反应=总反应-第I步反应,则第II步反应为CH3I(l) +HI(aq)= I2(aq)+ CH4(g),总反应的平均速率由慢反应决定,I2为慢反应的反应物,增大I2的浓度,慢反应的反应速率增大,则总反应的反应速率增大(或根据总反应和两步反应可知,I2可为该反应的催化剂,增大I2的浓度,可以增大总反应的平均反应速率);
(3)由表中数据可知,添加Na助剂时其他副反应占比大,添加Cu助剂时CO2转化率低,兼顾乙烯的产率、CO2转化率和对副反应的影响,选择添加K助剂效果最好,不仅能提高单位时间内乙烯产量,并且其他副反应占比少,根本原因是降低反应的活化能、加快乙烯生成速率;
(4)根据图示,升高温度,CH4的物质的量分数减小,说明升高温度,平衡正移,正反应为吸热反应,△H>0;为提高H2S的平衡转化率,即平衡正移,除改变温度外,还可减小体系压强、及时分离出产物、减小起始时![]() 等;N点时,n(H2S)%=n(H2)%,设起始加入甲烷物质的量为3mol,转化甲烷物质的量为xmol,列“三段式”:
等;N点时,n(H2S)%=n(H2)%,设起始加入甲烷物质的量为3mol,转化甲烷物质的量为xmol,列“三段式”:
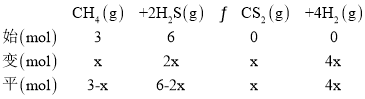
6-2x=4x,解出x=1,平衡时体系总物质的量为(2+4+1+4)mol=11mol,平衡常数KP= =
=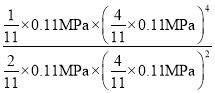 =8×10-4( MPa)2;
=8×10-4( MPa)2;
(5)该装置为电解池,根据图示,O2在电极表面转化为H2O,氧元素的化合价降低,得电子,发生还原反应,则通入氧气的一极为阴极,电源电极B为负极,A为正极,故通入一氧化碳和甲醇的一极为阳极,阳极的电极反应为2CH3OH+CO-2e-=(CH3O)2CO+2H+,阴极的电极反应为:O2+4H++4e-=2H2O,根据阴极反应,氧气和氢离子结合产生水,氢离子来自于阳极反应的产物,则H+透过交换膜向阴极移动,则离子交换膜a为阳膜。

【题目】“绿水青山就是金山银山”,运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对工业生产、缓解环境污染、解决能源危机等具有重要意义。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原氧化铁的热化学方程式为_____________。
(2)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.410-7 | 1.310-7 |
Ka2 | 4.710-11 | 7.110-15 |
①煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为_______;
②常温下,0.1mol·L-1 NaHCO3溶液和0.1mol·L-1 NaHS溶液的pH相比,pH较小的为________ 溶液(填化学式)。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH (此反应在低温时为自发反应)。
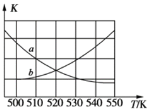
①下图能表示该反应的平衡常数K与温度T之间的变化关系曲线为_____(填“a”或“b”),其判断依据是__________。
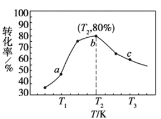
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如下图所示,则在该时间段内,恰好达到化学平衡时,此时容器内的压强与反应开始时的压强之比为_____________。
(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成28g N2时,转移的电子数为____mol(结果保留三位有效数字)。
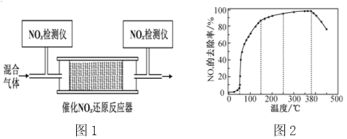
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置如图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是______;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是____。