题目内容
4.提纯对热稳定的,高沸点液态有机物和低沸点的杂质的混合物,一般使用的方法( )| A. | 重结晶 | B. | 蒸馏 | C. | 过滤 | D. | 分液 |
分析 高沸点液态有机物和低沸点的杂质的混合物,互溶,沸点差异较大,以此来解答.
解答 解:A.重结晶分离溶质的溶解度受温度影响较大的可溶性固体与液体混合物,故A不选;
B.高沸点液态有机物和低沸点的杂质的混合物,选择蒸馏法分离,故B选;
C.过滤分离不溶性固体与液体,故C不选;
D.分液分离分层的液体混合物,故D不选;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,注意分离方法的应用,题目难度不大.

练习册系列答案
相关题目
14.下列有关化学用语表达不正确的是( )
| A. | CO2的电子式: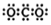 | |
| B. | CS2分子的结构式:S=C=S | |
| C. | S2-的结构示意图: | |
| D. | 8个中子的碳原子的核素符号:${\;}_6^{14}C$ |
15.下列各化合物的命名错误的是( )
| A. |  1,2-二甲苯 1,2-二甲苯 | B. | CH2=CH-CH=CH2 1,3-二丁烯 | ||
| C. |  2-丁醇 2-丁醇 | D. |  2-甲基丁烷 |
12.下列说法正确的是( )
| A. | 水可以用来分离溴苯和苯的混合物 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 环己烷与苯可用酸性KMnO4溶液鉴别 | |
| D. | 植物油氢化过程中发生了加成反应 |
19.下列各组物质中,化学键类型相同,晶体类型也相同的是( )
| A. | C(金刚石)和CO2 | B. | NaBr和HBr | C. | Cl2和KCl. | D. | CH4和H2O? |
9.等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则产生氢气在标准状况下的体积比是( )
| A. | 3:4 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
16.下列说法正确的是( )
| A. | 在周期表中金属与非金属的分界处可以找到半导体材料 | |
| B. | H2S、HCl、HF的热稳定性依次减弱 | |
| C. | NaOH、KOH、Mg(OH)2的碱性依次减弱 | |
| D. | Cl、S、P元素的非金属性依次增强 |
13.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | 稳定性:H2O>H2S | H2O分子间存在氢键,H2S则无 |
| B | 沸点:SiO2>CO2 | 相对分子质量越大,沸点越高 |
| C | 密度:干冰>冰 | 干冰晶体属于分子密堆积 |
| D | 熔点:MgO>NaCl | MgO晶格能大于NaCl |
| A. | A | B. | B | C. | C | D. | D |
14.对化学反应2SO2+O2$?_{△}^{催化剂}$2SO2的叙述错误的是( )
| A. | 该反应属于可逆反应 | |
| B. | 达到平衡后各物质的浓度不再变化 | |
| C. | 加入的SO2与O2最终全部转化成SO3 | |
| D. | 单位时间内,消耗0.2 mol SO2的同时生成0.2 mol SO3 |