题目内容
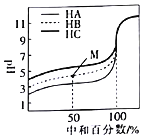
【题目】MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示,下列叙述中正确的是
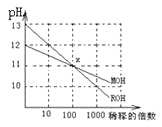
A.MOH和ROH都是强碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10c(MOH)
D.常温下,pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性
【答案】B
【解析】
由图可知,ROH的pH=13时稀释100倍,pH变为11,则ROH为强碱;而MOH的pH=12时稀释100倍,pH变为11,则说明MOH为弱碱,以此来解答。
A.由图可知,ROH的pH=13时稀释100倍,pH变为11,则ROH为强碱,故A错误;
B.在X点,pH相同,则c(OH-)相同,由电荷守恒可知,c(M+)=c(R+),故B正确;
C.ROH为强碱,稀释前浓度为0.1mol/L,MOH的pH=12时稀释100倍,pH变为11,则说明MOH为弱碱,稀释前MOH的浓度大于0.01mol/L,则稀释前c(ROH)<10c(MOH),故C错误;
D.设醋酸的pH=a,ROH的pH=14-a,则醋酸和ROH溶液等体积混合时V×10-amol/L=V×1014-a-14mol/L,说明二者溶液中电离出的氢离子和氢氧根离子浓度相等,因醋酸为弱酸,不能完全电离,所以醋酸的浓度大于10-amol/L,醋酸有剩余,溶液显酸性,故D错误;
故选:B。

【题目】某同学在实验室研究锌与酸的反应,实验数据如下:
实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
1 | 0.10 g | 颗粒 | 0.5mol·L-1 | 50mL | 500s |
2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
分析上述数据,回答下列问题
(1)实验1和2表明,_____对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a =________ g。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。

该同学对产生这一现象的原因,提出两种假设:
a. 氯离子对反应起促进作用,加快了反应的进行;
b. ________,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___ (结合化学方程式作出合理解释)。
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是 ______。
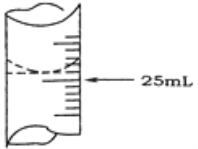
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为______________ 。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为_____________ (小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高(_________) (填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是____。