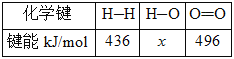
题目内容
【题目】在一固定容积的密闭容器中进行如下反应:CO2(g)+H2(g)CO(g)+H2O(g),其平衡常数K和温度t的关系如下:
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为: .
(2)该反应的正反应为 反应(“吸热”或“放热”).
(3)能判断该反应是否已经达到化学平衡状态的是 .
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
【答案】(1)![]() ;(2)放热;(3)B、C;
;(2)放热;(3)B、C;
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式可知该反应的平衡常数表达式K=![]() ;
;
(2)根据表中数据可知升高温度平衡常数K减小,说明反应向逆反应方向进行,因此正反应是放热反应。
(3)A.反应前后体积不变,则容器中压强始终不变,不能说明反应达到平衡状态,A错误;B.混合气体中CO浓度不变,说明反应达到平衡状态,B正确;C.v正(H2)=v逆(H2O)表示正逆反应速率,且满足反应速率之比是相应化学计量数之比,因此反应达到平衡状态,C正确;D.c(CO2)=c(CO)不能说明正逆反应速率是否相等,因此不一定达到平衡状态,D错误,答案选BC。

【题目】下列实验操作和现象对应的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
B | 物质的量之比为2:3的稀硝酸和稀硫酸
| 反应结束后,锥形瓶中溶液的溶质是CuSO4,集气瓶中收集到的气体是NO |
C | 向1mL浓度均为0.05mol·L-1NaCl、NaI的混合溶液中滴加2滴0.01mol·L-1AgNO3溶液,振荡,沉淀是黄色 | Ksp(AgCl)<Ksp(AgI) |
D | 室温下,用pH试纸测得0.1mol·L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
A. A B. B C. C D. D
【题目】下表为元素周期表的一部分。回答下列问题:
(1)Z元素在周期表中的位置为_________。
(2)表中元素原子半径最大的是(填元索符号)_________。
碳 | 氮 | Y | |
X | 硫 | Z |
(3)下列亊实能说明Y元素的非金属性比S元素的非金属性强的__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,lmolY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成lmolX的最高价化合物,恢复至室温,放热687kJ,己知该化合,物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________。
(5)碳与镁形成的lmol化合物Q与水反应,生成2molMg(OH)2和lmol烃,该烃分子中碳氢质量比为9:1,烃的电子式为_______,Q与水反应的化学方程式为 _________________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗lL2.2mol/LNaOH溶液和1molO2,則两种气体的分子式及物质的量分别为_____________,生成硫酸铜物质的量为_________________。