题目内容
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
|
方法Ⅰ |
用炭粉在高温条件下还原CuO |
|
方法Ⅱ |
电解法,反应为2Cu +
H2O |
|
方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
 △H
>0
△H
>0
水蒸气的浓度随时间t变化如下表所示。
|
序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
|
① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
|
② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
|
③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
(1)由于在高温下,碳有可能把氧化铜还原生成铜,即不易控制反应条件。(2分)
(2)-(a+b-2c)kJ/mol。或2c –a-b(2分) (3)2Cu-2e-+2OH-=Cu2O+H2O。(2分)
(4)4Cu(OH)2 + N2H4 2Cu2O + N2↑ + 6H2O。(2分) (5)C(1分)
2Cu2O + N2↑ + 6H2O。(2分) (5)C(1分)
【解析】
试题分析:(1)由于在高温下,碳有可能把氧化铜还原生成铜,不易控制反应条件,所以一般不用方法I。
(2)根据盖斯定律可知,①+②-③×2即得到反应2CuO(s)+C(s)= Cu2O(s)+CO(g),所以该反应的反应热△H =-akJ/mol-bkJ/mol+2ckJ/mol=-(a+b-2c)kJ/mol。
(3)铜电极和电源的正极相连,做阳极,失去电子,则电极反应式是2Cu-2e-+2OH-=Cu2O+H2O。
(4)根据原子守恒可知,生成物还有水生成,所以反应的化学方程式是4Cu(OH)2 + N2H4 2Cu2O + N2↑ + 6H2O。
2Cu2O + N2↑ + 6H2O。
(5)该反应是吸热反应反应,则升高温度平衡向正反应方向移动,所以水蒸气的转化率高,则根据表中数据可知,温度应该是T2>T1,A不正确;实验①前20 min的平均反应速率 v(O2)= =3.5×10-5 mol·L-1
min-1,B不正确;实验②比实验①达到平衡所用的时间少,说明反应速率快,使用的催化剂催化效率高,C正确,答案选C。
=3.5×10-5 mol·L-1
min-1,B不正确;实验②比实验①达到平衡所用的时间少,说明反应速率快,使用的催化剂催化效率高,C正确,答案选C。
考点:考查反应反应热、反应速率的计算、电极反应式和化学方程式的书写以及外界条件对反应速率和平衡状态的影响
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。

(10分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -169kJ·mol-1
C(s)+1/2O2(g)="CO(g) " △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)="CuO(s) " △H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = ▲ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 ▲ 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放
 出N2。该制法的化学方程式为 ▲ 。
出N2。该制法的化学方程式为 ▲ 。(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
 △H>0,水蒸气的浓度随时间t变化如下表所示。
△H>0,水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是 ▲ (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率v(H2)=7×10-5 mol·L-1 min—1
C.实验②比实验①所用的催化剂催化效率高
(13分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
|
方法Ⅰ |
用炭粉在高温条件下还原CuO |
|
方法Ⅱ |
电解法,反应为2Cu
+ H2O |
|
方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H >0
△H >0
水蒸气的浓度随时间t变化如下表所示。
|
序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
|
① |
T1 |
0.050 |
0.0492 |
0.0486 |
0.0482 |
0.0480 |
0.0480 |
|
② |
T1 |
0.050 |
0.0488 |
0.0484 |
0.0480 |
0.0480 |
0.0480 |
|
③ |
T2 |
0.10 |
0.094 |
0.090 |
0.090 |
0.090 |
0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
(10分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
|
方法Ⅰ |
用炭粉在高温条件下还原CuO |
|
方法Ⅱ |
电解法,反应为2Cu + H2O |
|
方法Ⅲ |
用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是 ▲ 。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = ▲ kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 ▲ 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 ▲ 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: △H>0,水蒸气的浓度随时间t变化如下表所示。
△H>0,水蒸气的浓度随时间t变化如下表所示。

下列叙述正确的是 ▲ (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min—1
C.实验②比实验①所用的催化剂催化效率高
 Cu2O + H2↑。
Cu2O + H2↑。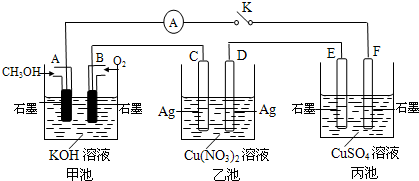
 Cu2O + H2↑。
Cu2O + H2↑。 Cu2O + H2↑。
Cu2O + H2↑。