题目内容
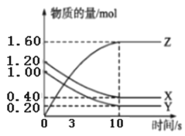
【题目】在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是( )
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是( )
A.x=2
B.2min时,容器内的压强为开始时的80%
C.2min时,B的反应速率为0.1mol·L-·min-
D.A的转化率为40%
【答案】D
【解析】
A. 2min末测得此时容器中C和D的浓度为0.2 molL1和0.4 molL1,根据浓度改变量之比等于计量系数之比得出x=1,故A错误;
B. 该反应是等体积反应,由于是固定容器,因此2min时容器内的压强和原来的压强相同,故B错误;
C. 2 min末测得此时容器中D的浓度为0.4 molL1,则B浓度改变量为0.2 molL1,因此2 min内B的反应速率为0.1mol·L1·min1,2 min时是指的瞬时速率,故C错误;
D. 2min末测得此时容器中D的浓度为0.4 molL1,则A浓度改变量为0.6 molL1,Δn(A) =0.6 molL1×2L =1.2mol,A的转化率为![]() ,故D正确。
,故D正确。
综上所述,答案为D。

【题目】下表列出前20号元素中的某些元素性质的一些数据:
元素 | A | B | C | D | E | F | G | H | I | J |
原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是____(填编号)。比元素B原子序数大10的元素在元素周期表中的位置:第____周期第____族,其基态原子的核外电子排布式是___________。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是____(写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是_________、___________。
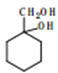
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。 其分子中共形成____个σ键,____个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第_____周期、第____族。
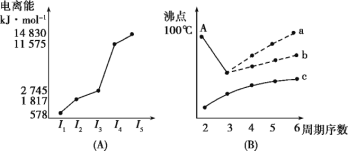
图(B)是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第____族元素氢化物的沸点的变化规律。不同同学对某主族元素的氢化物的沸点变化趋势画出了两条折线——折线a和折线b,你认为正确的是____,理由是_______________。