题目内容
煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.5kJ?mol-1
①在一体积为2L的密闭容器中,加入1mol C和2mol H2O(g),达平衡H2O(g)的转化率为20%,请计算此时的平衡常数
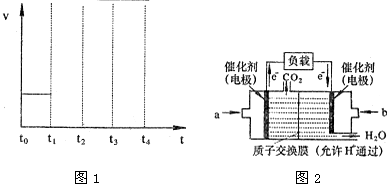
②若容器体积不变,反应在t0时达到平衡,平衡常数为K1;在t1时升高温度,t2重新达到平衡,平衡常数为K2;t3时充入水蒸气,t4时重新达到平衡;平衡常数为K3;请在下面的反应速率与时间关系图1中用直线画出t1到t4正反应速率的变化情况,并比较K1、K2、K3的数值 (用“>”、“<”或“=”)
③又知C(s)+CO2(g)?2CO(g)△H=+172.5kJ?mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H为
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)?CH3OH(g).甲醇是一种燃料,可用于设计燃料电池.图2是甲醇燃料电池的原理示意图,电解质溶液为稀硫酸.
①a处通入的是
②该电池工作过程中,H+的移动方向为从

(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.5kJ?mol-1
①在一体积为2L的密闭容器中,加入1mol C和2mol H2O(g),达平衡H2O(g)的转化率为20%,请计算此时的平衡常数
0.27
0.27
;②若容器体积不变,反应在t0时达到平衡,平衡常数为K1;在t1时升高温度,t2重新达到平衡,平衡常数为K2;t3时充入水蒸气,t4时重新达到平衡;平衡常数为K3;请在下面的反应速率与时间关系图1中用直线画出t1到t4正反应速率的变化情况,并比较K1、K2、K3的数值 (用“>”、“<”或“=”)
K1<K2=K3
K1<K2=K3
;③又知C(s)+CO2(g)?2CO(g)△H=+172.5kJ?mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H为
-41kJ?mol-1
-41kJ?mol-1
;(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)?CH3OH(g).甲醇是一种燃料,可用于设计燃料电池.图2是甲醇燃料电池的原理示意图,电解质溶液为稀硫酸.
①a处通入的是
甲醇
甲醇
(填物质名称),左侧电极上发生的电极反应式为CH3OH+H2O-6e-=CO2+6H+
CH3OH+H2O-6e-=CO2+6H+
;②该电池工作过程中,H+的移动方向为从
左
左
到由
由
(填“左“或“右“).分析:(1)①根据转化计算参加反应的水的物质的量,计算水的浓度变化量,利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
②该反应正反应是吸热反应,t1时升高温度,正反应速率增大更多,随后降低,平衡向正反应方向移动,平衡时速率增大,平衡常数增大,t2重新达到平衡,
t3时充入水蒸气,正反应速率增大,平衡向正反应方向移动,平衡时速率增大,温度与t2时相同,平衡常数不变,据此解答;
③根据盖斯定律构造目标热化学方程式,据此计算反应热;
(2)①电池总反应为:2CH3OH+3O2=2CO2+4H2O,原电池中电子从负极经外电路流向正极,由图可知,左侧电极流出电子,为负极,发生氧化反应,所以,a处通入甲醇,甲醇生成二氧化碳,由离子交换膜可知还生成氢离子;
②甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路通过质子交换膜到达另一极与氧气反应.
②该反应正反应是吸热反应,t1时升高温度,正反应速率增大更多,随后降低,平衡向正反应方向移动,平衡时速率增大,平衡常数增大,t2重新达到平衡,
t3时充入水蒸气,正反应速率增大,平衡向正反应方向移动,平衡时速率增大,温度与t2时相同,平衡常数不变,据此解答;
③根据盖斯定律构造目标热化学方程式,据此计算反应热;
(2)①电池总反应为:2CH3OH+3O2=2CO2+4H2O,原电池中电子从负极经外电路流向正极,由图可知,左侧电极流出电子,为负极,发生氧化反应,所以,a处通入甲醇,甲醇生成二氧化碳,由离子交换膜可知还生成氢离子;
②甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路通过质子交换膜到达另一极与氧气反应.
解答:解:(1)①达平衡H2O(g)的转化率为20%,参加反应的水的物质的量=2mol×20%=0.4mol,水的浓度变化量为
=0.2mol/L,则:
C(s)+H2O(g)?CO(g)+H2(g)
开始(mol/L):1 0 0
变化(mol/L):0.4 0.4 0.4
开始(mol/L):0.6 0.4 0.4
故平衡常数k=
=0.27,
故答案为:0.27;
②该反应正反应是吸热反应,t1时升高温度,正反应速率增大更多,随后降低,平衡向正反应方向移动,平衡时速率增大,平衡常数增大,t2重新达到平衡,
t3时充入水蒸气,正反应速率增大,平衡向正反应方向移动,平衡时速率增大,温度与t2时相同,平衡常数不变,t1到t4正反应速率的变化情况为: ,故平衡常数K1<K2=K3,
,故平衡常数K1<K2=K3,
故答案为: ;K1<K2=K3;
;K1<K2=K3;
③已知:①C(s)+H2O(g)?CO(g)+H2(g);△H=131.5kJ?mol-1
②C(s)+CO2(g)?2CO(g);△H=172.5kJ?mol-1
所以①-②得,CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ?mol-1;
故答案为:-41kJ?mol-1;
(2)①电池总反应为:2CH3OH+3O2=2CO2+4H2O,原电池中电子从负极经外电路流向正极,由图可知,左侧电极流出电子,为负极,发生氧化反应,所以,a处通入甲醇,甲醇放电生成二氧化碳,由离子交换膜可知还生成氢离子,a电极的电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
故答案为:甲醇;CH3OH+H2O-6e-=CO2+6H+;
②甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路通过质子交换膜到达另一极与氧气反应.所以H+的移动方向为从左到右,
故答案为:左;右.
| 0.4mol |
| 2L |
C(s)+H2O(g)?CO(g)+H2(g)
开始(mol/L):1 0 0
变化(mol/L):0.4 0.4 0.4
开始(mol/L):0.6 0.4 0.4
故平衡常数k=
| 0.4×0.4 |
| 0.6 |
故答案为:0.27;
②该反应正反应是吸热反应,t1时升高温度,正反应速率增大更多,随后降低,平衡向正反应方向移动,平衡时速率增大,平衡常数增大,t2重新达到平衡,
t3时充入水蒸气,正反应速率增大,平衡向正反应方向移动,平衡时速率增大,温度与t2时相同,平衡常数不变,t1到t4正反应速率的变化情况为:
 ,故平衡常数K1<K2=K3,
,故平衡常数K1<K2=K3,故答案为:
 ;K1<K2=K3;
;K1<K2=K3;③已知:①C(s)+H2O(g)?CO(g)+H2(g);△H=131.5kJ?mol-1
②C(s)+CO2(g)?2CO(g);△H=172.5kJ?mol-1
所以①-②得,CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ?mol-1;
故答案为:-41kJ?mol-1;
(2)①电池总反应为:2CH3OH+3O2=2CO2+4H2O,原电池中电子从负极经外电路流向正极,由图可知,左侧电极流出电子,为负极,发生氧化反应,所以,a处通入甲醇,甲醇放电生成二氧化碳,由离子交换膜可知还生成氢离子,a电极的电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
故答案为:甲醇;CH3OH+H2O-6e-=CO2+6H+;
②甲醇在催化剂作用下提供质子和电子,电子经外电路、质子经内电路通过质子交换膜到达另一极与氧气反应.所以H+的移动方向为从左到右,
故答案为:左;右.
点评:本题考查影响平衡的因素、化学平衡常数、化学平衡图象、反应热的计算、原电池等,难度中等,(2)中注意根据离子交换膜判断有氢离子生成是关键,可以利用总反应式减去正极反应式进行书写.

练习册系列答案
相关题目
(17分)随着世界工业经济的发展、人口的剧增,全球能源紧缺面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为: C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
①该反应的平衡常数表达式为 。
②下列措施中,不能提高碳的转化率的是 (填字母序号)
| A.容器的体积不变,增加水蒸气的物质的量 | B.缩小容器的体积,增大压强 |
| C.及时将水煤气从容器中移走 | D.其他条件不变,升高温度 |
 ③又知C(s)+CO2(g) 2CO(g) △H=+172.5kJ·mol-1
③又知C(s)+CO2(g) 2CO(g) △H=+172.5kJ·mol-1 则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。
则CO(g)+H2O(g) CO2(g)+H2(g)的焓变(△H)为 。 (2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图:
(2)CO和H2在一定条件下可反应生成甲醇,CO(g)+2H2(g) CH3OH(g)。甲醇作为一种可再生能源燃料,可用于燃料电池。下图是甲醇燃料的原理示意图: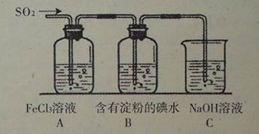
①a处通入的是 (填物质名称),该电池工作过程中,H+的移动方向
为从 到 (填“左”或“右”)
②该电池正极反应式为 。
③若用该电池提供的电能电解600ml 0.2mol·L-1NaCl溶液,设有0.01molCH3OH完全放电,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解时阴极反应式为 ,电解结束后所得溶液的pH= 。若向电解后的溶液加入适量的醋酸至溶液的pH恰好等于7(反应前后忽略溶液体积的变化),则此时溶液中c(Na+):c(CH3COO-)= 。

 C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
C(s)+H2O(g) CO(g)+H2(g) △H=+131.5kJ·mol-1
 CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1 ①a处通入的是
(填物质名称),左侧电极上发
①a处通入的是
(填物质名称),左侧电极上发