题目内容
已知H2A在水中的电离方程式是:H2A═H++HA- HA-?H++A2-,回答下列问题:
(1)Na2A溶液显 (填“酸性”,“中性”或“碱性”).理由是(用离子方程式表示) .
(2)在0.1mol?L-1的Na2A溶液中,下列微粒浓度关系正确的有 .
A.c(A2-)+c(HA-)+c(H2A)=0.1mol?L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)如果25℃时,0.1mol?L-1的NaHA溶液中c(A2-)=0.029mol?L-1,则0.1mol?L-1H2A溶液中c(A2-) 0.029mol?L-1(填“<”,“>”或“=”),理由是 .
(4)0.1mol?L-1NaHA溶液中各种离子浓度由大到小的顺序是: .
(5)如果25℃时,0.10mol?L-1H2A溶液的pH=-lg0.11,则25℃时,0.10mol?L-1的H2A溶液中c(A2-)= .
(1)Na2A溶液显
(2)在0.1mol?L-1的Na2A溶液中,下列微粒浓度关系正确的有
A.c(A2-)+c(HA-)+c(H2A)=0.1mol?L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(3)如果25℃时,0.1mol?L-1的NaHA溶液中c(A2-)=0.029mol?L-1,则0.1mol?L-1H2A溶液中c(A2-)
(4)0.1mol?L-1NaHA溶液中各种离子浓度由大到小的顺序是:
(5)如果25℃时,0.10mol?L-1H2A溶液的pH=-lg0.11,则25℃时,0.10mol?L-1的H2A溶液中c(A2-)=
分析:(1)由HA-?H++A2-可知,Na2A为强碱弱酸盐;
(2)根据溶液中的电荷守恒、物料守恒以及质子守恒来回答;
(3)0.1mol?L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol?L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离;
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离分析;
(5))H2A的第一步电离是完全电离,第二步电离是不完全电离,溶液中c(A2-)等于第二步电离的氢离子浓度.
(2)根据溶液中的电荷守恒、物料守恒以及质子守恒来回答;
(3)0.1mol?L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol?L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离;
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离分析;
(5))H2A的第一步电离是完全电离,第二步电离是不完全电离,溶液中c(A2-)等于第二步电离的氢离子浓度.
解答:解:(1)由HA-?H++A2-可知,Na2A为强碱弱酸盐,A2-水解显碱性,水解离子反应为A2-+H2O?HA-+OH-,
故答案为:碱性;A2-+H2O?HA-+OH-;
(2)已知H2A在水中的电离方程式是:H2A═H++HA- HA-?H++A2-,HA-只电离不水解
A、0.1mol/L的Na2A溶液中,弱离子会水解,c(A2-)+c(HA-)=0.1mol?L-1,故A错误;
B、在溶液中,根据质子守恒得:c(OH-)=c(H+)+c(HA-),故B正确;
C、0.1mol/L的Na2A溶液中,存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C正确;
D、根据B、C可以得出c(Na+)=2c(A2-)+2c(HA-),故D正确;
故答案为:BCD;
(3)0.1mol?L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol?L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,
故答案为:<;H2A第一步电离生成的H+抑制了HA-的电离;
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,则c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
(5)H2A的第一步电离是完全电离,第二步电离是不完全电离,第二步电离的氢离子浓度等于c(A2-),0.10mol?L-1 H2A溶液中第一步电离得到的氢离子浓度为0.1mol/L,因为溶液的pH=-lg0.11,所以第二步电离的氢离子浓度为0.01mol/L,溶液中c(A2-)等于第二步电离的氢离子浓度,则0.10mol?L-1的H2A溶液中c(A2-)=0.010mol/L,
故答案为:0.010mol?L-1.
故答案为:碱性;A2-+H2O?HA-+OH-;
(2)已知H2A在水中的电离方程式是:H2A═H++HA- HA-?H++A2-,HA-只电离不水解
A、0.1mol/L的Na2A溶液中,弱离子会水解,c(A2-)+c(HA-)=0.1mol?L-1,故A错误;
B、在溶液中,根据质子守恒得:c(OH-)=c(H+)+c(HA-),故B正确;
C、0.1mol/L的Na2A溶液中,存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C正确;
D、根据B、C可以得出c(Na+)=2c(A2-)+2c(HA-),故D正确;
故答案为:BCD;
(3)0.1mol?L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol?L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,
故答案为:<;H2A第一步电离生成的H+抑制了HA-的电离;
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,则c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
(5)H2A的第一步电离是完全电离,第二步电离是不完全电离,第二步电离的氢离子浓度等于c(A2-),0.10mol?L-1 H2A溶液中第一步电离得到的氢离子浓度为0.1mol/L,因为溶液的pH=-lg0.11,所以第二步电离的氢离子浓度为0.01mol/L,溶液中c(A2-)等于第二步电离的氢离子浓度,则0.10mol?L-1的H2A溶液中c(A2-)=0.010mol/L,
故答案为:0.010mol?L-1.
点评:本题考查盐类水解及离子浓度大小的比较,明确习题中的信息是解答本题的关键,注意二元酸的两步电离特点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
研究化学反应原理对生产生活很有意义,请用化学反应原理的相关知识回答下列问题:
(1)用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是______ ______
______
(填写序号)
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s)+4H+(aq)+  (aq)+4e- (aq)+4e- PbSO4(s)+2H2O(1) PbSO4(s)+2H2O(1) |
| D.若四个电极材料均为石墨,当析出6.4g Cu时,两池中共产生气体3.36L(标准 |
(2)某二元酸H2A在水中的电离方程式是:H2A=H++HA-;HA-
 H++A2-,请回答下列问题:
H++A2-,请回答下列问题:①Na2A溶液显_________(填“酸性”、“中性”或“碱性”),理由是________________
(用离子方程式表示)。
②已知0.1
 mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.
mol·L-1的NaHA溶液的pH=2,则0.1mol·L-1的H2A溶液中氢离子的物质的量浓度可能是__________0.1lmol·L-1(填“<”、“>”或“=”),理由是:___________________________.(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g); △H=-90.8kJ·mol-1
CH3OH(g); △H=-90.8kJ·mol-1②2
 CH3OH(g)
CH3OH(g) CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g); △H=-23.5kJ·mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g);△=-41.3kJ·mol-1
CO2(g)+H2(g);△=-41.3kJ·mol-1写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式___________________.
(4)SO2是硫酸生产的重要中间产物,也是空气污染的主要原因之一,其氧化生成SO3的反应为:2SO2(g)+O2(g)
 2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23 mol SO2和0.11 mol氧气放入容积为l L的密闭容器中发生反应,达到平衡后得到0.12 mol SO3,则反应的平衡常数K=________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO3的体积分数将___________(填“增大”、“不变”或“减小”)。 
 2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________
2PbSO4(s)+2H2O(1)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________ (aq)+4e-
(aq)+4e- PbSO4(s)+2H2O(1)
PbSO4(s)+2H2O(1) H++A2-,请回答下列问题:
H++A2-,请回答下列问题: 2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。
2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。 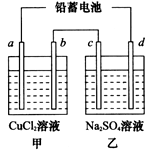
 H++A2-。
H++A2-。  CH3OH(g) △H=-90.8kJ/mol
CH3OH(g) △H=-90.8kJ/mol  CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol  CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol  2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。