题目内容
有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;②Z与Y可组成化合物ZY3,ZY3溶液遇KSCN呈血红色.请回答:
(1)Y的最高价氧化物对应水化物的化学式是 .
(2)将ZY3溶液滴入沸水中可得到红褐色液体,反应的离子方程式是 .此液体具有的性质是 (填写序号字母).
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体,该气体与含1.5mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物.若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 .
(1)Y的最高价氧化物对应水化物的化学式是
(2)将ZY3溶液滴入沸水中可得到红褐色液体,反应的离子方程式是
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体,该气体与含1.5mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物.若有1.5×6.02×1023个电子转移时,该反应的化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:有X、Y、Z三种元素,Z与Y可组成化合物ZY3,ZY3溶液遇KSCN呈血红色,为FeCl3,故Z为Fe元素,Y为Cl元素,X2-、Cl-均与Cl元素的气态氢化物分子具有相同的电子数,为18个电子,故X为S元素;
(1)Cl元素的最高价氧化物对应水化物的化学式是HClO4;
(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,所形成的溶液具有胶体的性质,氢氧化铁胶体胶粒带正电荷,会发生电泳现象,溶液中含有氯离子,将溶液蒸干促进水解,最终氢氧化铁分解生成氧化铁;
(3)硫单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2,Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),故该酸为HClO3,该酸具有强氧化性,将二氧化硫氧化为硫酸,根据转移电子数计算氯元素在氧化物中化合价,判断氧化物化学式,据此书写.
(1)Cl元素的最高价氧化物对应水化物的化学式是HClO4;
(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,所形成的溶液具有胶体的性质,氢氧化铁胶体胶粒带正电荷,会发生电泳现象,溶液中含有氯离子,将溶液蒸干促进水解,最终氢氧化铁分解生成氧化铁;
(3)硫单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2,Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),故该酸为HClO3,该酸具有强氧化性,将二氧化硫氧化为硫酸,根据转移电子数计算氯元素在氧化物中化合价,判断氧化物化学式,据此书写.
解答:
解:有X、Y、Z三种元素,Z与Y可组成化合物ZY3,ZY3溶液遇KSCN呈血红色,为FeCl3,故Z为Fe元素,Y为Cl元素,X2-、Y-均与Cl元素的气态氢化物分子具有相同的电子数,为18个电子,故X为S元素,
(1)Cl元素的最高价氧化物对应水化物为高氯酸,高氯酸的化学式为:HClO4,
故答案为:HClO4;
(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,反应的离子方程式是Fe3++3H2O
Fe(OH)3(胶体)+3H+,
a.氢氧化铁胶体具有丁达尔效应,故a正确;
b.胶体胶粒带有正电荷,通直流电后,发生电泳现象,负极附近液体颜色加深,故b正确;
c.所得的溶液中含有氯离子,向该液体中加入硝酸银溶液,有沉淀产生,故c错误;
d.将该液体加热、蒸干、灼烧后,有氧化铁生成,故d正确;
故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+;abd;
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2,Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),则该酸为HClO3,SO2与含1.5molHClO3溶液在一定条件下反应,可生成一种强酸为和一种氧化物,该强酸为H2SO4,Cl元素在氧化物中化合价为x,则(5-x)×1.5×6.02×1023=1.5×6.02×1023,解得x=4,
故氧化物为ClO2,该反应方程式为:SO2+2HClO3=H2SO4+2ClO2,
故答案为:SO2+2HClO3=H2SO4+2ClO2.
(1)Cl元素的最高价氧化物对应水化物为高氯酸,高氯酸的化学式为:HClO4,
故答案为:HClO4;
(2)将FeCl3溶液滴入沸水中发生水解反应生成氢氧化铁胶体,反应的离子方程式是Fe3++3H2O
| ||
a.氢氧化铁胶体具有丁达尔效应,故a正确;
b.胶体胶粒带有正电荷,通直流电后,发生电泳现象,负极附近液体颜色加深,故b正确;
c.所得的溶液中含有氯离子,向该液体中加入硝酸银溶液,有沉淀产生,故c错误;
d.将该液体加热、蒸干、灼烧后,有氧化铁生成,故d正确;
故答案为:Fe3++3H2O
| ||
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体为SO2,Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气),则该酸为HClO3,SO2与含1.5molHClO3溶液在一定条件下反应,可生成一种强酸为和一种氧化物,该强酸为H2SO4,Cl元素在氧化物中化合价为x,则(5-x)×1.5×6.02×1023=1.5×6.02×1023,解得x=4,
故氧化物为ClO2,该反应方程式为:SO2+2HClO3=H2SO4+2ClO2,
故答案为:SO2+2HClO3=H2SO4+2ClO2.
点评:本题考查位置结构与性质的关系,涉及常用化学用语书写、胶体性质、氧化还原反应计算等知识,题目难度中等,注意明确原子结构与元素周期律、元素周期表的关系,(3)中注意利用氧化还原反应规律计算氯元素在氧化物中的化合价.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
下列有关化学用语表示正确的是( )
A、氯离子的结构示意图: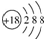 | ||
| B、明矾的化学式:KAl(SO4)2 | ||
C、中子数为10的氧原子:
| ||
D、溴化铵的电子式: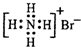 |
下列实验操作,现象或装置正确的是( )
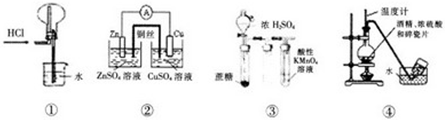

| A、实验①,氯化氢气体的吸收 |
| B、实验②,铜锌原电池 |
| C、实验③:酸性KMnO4溶液中出现气泡,且颜色不变 |
| D、实验④:实验室制取收集乙烯 |
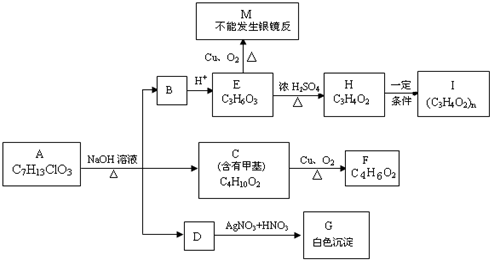
 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化: