题目内容
【题目】化学与生产、生活密切相关.下列叙述正确的是( )
A. 采用催化措施,将汽车尾气中的CO和NO转化为无害气体
B. 合金材料中不可能含有非金属元素
C. 信息产业中的光缆的主要成分是单质硅
D. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
【答案】A
【解析】
A.汽车尾气中的一氧化碳和一氧化氮在催化剂作用下反应生成无污染的气体二氧化碳和氮气,采用催化措施,将汽车尾气中的CO和NO转化为无害气体,故A正确; B.合金材料中可能含有金属元素,非金属元素,如生铁含有碳,故B错误;C.信息产业中的光缆的主要成分是二氧化硅,故C错误;D.14C与12C互为同位素,同素异形体是单质,故D错误;故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】目前钴酸锂(LiCoO2)锂离子电池应用十分广泛,从废旧钴酸锂理离子电池中回收铝、铁、钴、锂等元素成了重要的研究课题,某小组模拟工业流程从废旧电池中对上述元素进行提取。
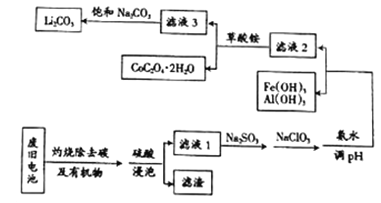
已知:①滤液1中阳离子有H+、CO3+、Fe3+、Al3+、Li+等;
②几种物质不同温度下的溶解度如下表所示:
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)钴酸锂(LiCoO2)中钴元素的化合价是_______________。
(2)上述流程中将CoO2-转化为Co3+的离子方程式为_________________。
(3)滤液1中加入Na2SO3的主要目的是_____________________;加入NaClO3的主要目的是____________。
(4)为了使Fe3+、Al3+沉淀完全(通常认为金属离子浓度小于或等于10-5mol·L-1时表示已沉淀完全)加入氨水调节pH的最小值是____________(保留一位小数)。{已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,lg3=0.52}
(5)滤液3中加入饱和Na2CO3溶液,过滤后,需要用“热水洗涤”的原因是_________。
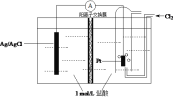
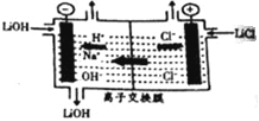
(6)为得到高纯度的Li2CO3,需将粗产品Li2CO3与盐酸反应制得的LiCl进行电解。其原理如图所示:
①电解时阳极的电解反应式为_____________________。
②电解后向产品LiOH溶液中加入过滤NH4HCO3溶液生成Li2CO3,反应的化学方程式为__________。