题目内容
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是
| A.X的氢化物溶于水显酸性 | B.Y的氧化物是共价化合物 |
| C.其离子半径大小: Z>Y>X | D.X和Z的最高价氧化物对应的水化物都是强酸 |
D
解析试题分析:根据题意可推知:X是N;Y是Mg;Z是S。A.X的氢化物溶于水显碱性,错误;B.Y的氧化物是离子化合物,错误;C.对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小;对于电子层结构不同的离子来说,核外电子层数越多,离子半径就越大,所以离子半径大小: Z>X>Y,错误;D.X和Z的最高价氧化物对应的水化物HNO3、H2SO4都是强酸,正确。
考点:考查元素的推断、元素形成的化合物的性质及微粒半径的比较的知识。

 名校课堂系列答案
名校课堂系列答案下列说法正确的是
①11H、21H、31H为三种不同的核素 ②11H、21H、31H互为同位素
③11H、21H、31H互为同素异形体 ④11H、21H、31H同系物 ⑤11H、21H、31H同分异构体
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置
⑦互为同位素的原子性质相同
| A.①②⑥ | B.①②③⑥ | C.①②⑥⑦ | D.①②③⑥⑦ |
下列关于碱金属元素和卤素的说法中,错误的是( )
| A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 |
| B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强 |
| C.钾与水的反应比钠与水的反应更剧烈 |
| D.溴单质与水的反应比氯单质与水的反应更剧烈 |
下列有关元素周期表的说法中,正确的是
| A.能生成碱的金属元素都在ⅠA族 |
| B.原子序数为14的元素位于元素周期表的第3周ⅥA族 |
| C.稀有气体元素原子的最外层电子数为2或8 |
| D.元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族 |
如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是 ( )
| | R | |
| X | Y | Z |
A.X的氢化物比R的氢化物稳定
B.原子半径大小顺序是Z>Y>X>R
C.Z的单质能与Y的某些化合物发生置换反应
D.X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构
下列元素中,属于p区元素的是
| A.H | B.O | C.Fe | D.Mg |
根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2e- =W,Y-2e- =Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是
| A.X>Z>Y>W | B.Z>W>X>Y | C.Z>X>Y>W | D.Z>Y>X>W |
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成1HmX分子,在a g 1HmX中所含质子的物质的量是
A.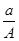 (A-N+m)mol (A-N+m)mol | B.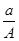 (A-N)mol (A-N)mol |
C.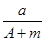 (A-N)mol (A-N)mol | D.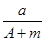 (A-N+m)mol (A-N+m)mol |
决定原子种类的因素是
| A.质子数和中子数 | B.质子数 | C.电子数 | D.质子数和电子数 |