题目内容
19.下列各组物质属于同分异构体的是( )| A. | 金刚石和石墨 | B. | 氨基乙酸和硝基乙烷 | ||
| C. |  和 和 | D. | 甲基丙烯酸和甲酸丙酯 |
分析 分子式相同、结构不同的化合物互为同分异构体,注意把握好三要素:分子式相同、结构不同、化合物.
解答 解:A、金刚石和石墨是碳元素组成的性质不同的单质,互称同素异形体,故A错误;
B、氨基乙酸与硝基乙烷(C2H5NO2)分子式相同,但结构不同,互为同分异构体,故B正确;
C、 的分子式为C12H10,
的分子式为C12H10, 的分子式为C10H8,分子式不同,不是同分异构体,故C错误;
的分子式为C10H8,分子式不同,不是同分异构体,故C错误;
D、甲基丙烯酸的分子式为C4H6O2,甲酸丙酯的分子式为C4H8O2,分子式不同,不是同分异构体,故D错误;
故选B.
点评 本题主要考查了同素异形体、同分异构体、同位素等基本概念,难度不大,明确这几个概念的区别是解本题的关键.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
9.下列说法不正确的是( )
| A. | 丁达尔现象可用于区别溶液与胶体,云、雾、墨水、有色玻璃均能产生丁达尔现象 | |
| B. | 原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团 | |
| C. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| D. | 分子间作用力比化学键弱得多,但它对物质熔点、沸点、溶解度有较大影响 |
10.下列说法正确的是( )
| A. | 以${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne的中子数相同,所以${\;}_{10}^{20}$Ne和${\;}_{10}^{22}$Ne互为同位素 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 | |
| C. | 二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 | |
| D. | C2H6分子中既含极性键又含非极性键 |
11.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)=c(OH-) | |
| B. | 0.1 mol•L-1 NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH${\;}_{4}^{+}$)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1 Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| D. | 0.1 mol•L-1 Na2C2O4溶液与0.1 mol•L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O${\;}_{4}^{2-}$)+c(HC2O${\;}_{4}^{-}$)+c(OH-)=c(Na+)+c(H+) |
8.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,44 g C3H8中含有的碳碳单键数为3NA | |
| B. | 1mol羟基中电子数为9NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |


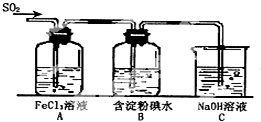 某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示: