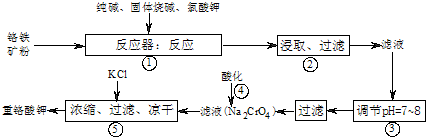
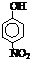
题目内容
(2008?肇庆二模)一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH+3O2+4OH-
2CO32-+6H2O,则有关说法正确的是( )
| 放电 |
| 充电 |
分析:根据2CH3OH+3O2+4OH-  2CO32-+6H2O知,甲醇失去电子发生氧化反应,所以负极上燃料发生电极反应;氧气得电子发生还原反应,所以正极为氧气得电子发生还原反应,根据电极反应式判断电极附近溶液的PH值变化.
2CO32-+6H2O知,甲醇失去电子发生氧化反应,所以负极上燃料发生电极反应;氧气得电子发生还原反应,所以正极为氧气得电子发生还原反应,根据电极反应式判断电极附近溶液的PH值变化.
 2CO32-+6H2O知,甲醇失去电子发生氧化反应,所以负极上燃料发生电极反应;氧气得电子发生还原反应,所以正极为氧气得电子发生还原反应,根据电极反应式判断电极附近溶液的PH值变化.
2CO32-+6H2O知,甲醇失去电子发生氧化反应,所以负极上燃料发生电极反应;氧气得电子发生还原反应,所以正极为氧气得电子发生还原反应,根据电极反应式判断电极附近溶液的PH值变化.解答:解:A、正极上得电子发生还原反应,根据2CH3OH+3O2+4OH-  2CO32-+6H2O知,放电时,氧气参与反应的电极为正极,故A错误.
2CO32-+6H2O知,放电时,氧气参与反应的电极为正极,故A错误.
B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故B正确.
C、2CH3OH+3 O2+4OH- 2CO32-+6H2O 转移电子
2CO32-+6H2O 转移电子
67.2L 12mol
5.6L 1mol
所以,标况下,通入5.6LO2并完全反应后,有1mol电子转移,故C错误.
D、放电时,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为
O2+3H2O+6e-=6OH-,所以通入氧气的电极附近溶液的pH升高,故D错误.
故选B.
 2CO32-+6H2O知,放电时,氧气参与反应的电极为正极,故A错误.
2CO32-+6H2O知,放电时,氧气参与反应的电极为正极,故A错误.B、放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故B正确.
C、2CH3OH+3 O2+4OH-
 2CO32-+6H2O 转移电子
2CO32-+6H2O 转移电子67.2L 12mol
5.6L 1mol
所以,标况下,通入5.6LO2并完全反应后,有1mol电子转移,故C错误.
D、放电时,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为
| 3 |
| 2 |
故选B.
点评:本题以燃料电池为载体考查了原电池原理,根据电池反应式判断正负极上发生反应的物质及电极附近溶液PH值的变化即可解答本题,难度较大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
 和
和 ;“双烯合成反应”又称为“Diels-Alder反应”,如:
;“双烯合成反应”又称为“Diels-Alder反应”,如: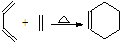 .
. ,则物质A的结构式为:
,则物质A的结构式为: 或CH2=CH-COOH
或CH2=CH-COOH
 中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:
中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:

 和
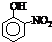
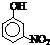
和 都是无色液体,下列物质中可以用来鉴别这两种物质的是
都是无色液体,下列物质中可以用来鉴别这两种物质的是