题目内容
向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述错误的是 ( )
| A.反应后溶液中c(Na+)=2c(SO42—) |
| B.a/2mol>沉淀的物质的量>0 |
| C.沉淀的质量=49a g |
| D.溶液中n(SO42—)=a/2 mol |
C
解析

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是
| 酸 | 电离平衡常数 |
| 醋酸 | K i=1.75×10-5 |
| 次氯酸 | K i=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
A.25℃,等PH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量最小的是Na2CO3
B.少量的SO2通入NaClO溶液中反应的离子方程式为:SO2 + H2O + 2ClO—
 SO32— + 2HClO
SO32— + 2HClOC.少量CO2通入Ca(ClO)2溶液中反应的离子方程式为:CO2 + H2O + ClO—
 HCO3— + HClO
HCO3— + HClOD.向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能
常温时,下列各溶液中有关粒子浓度的说法正确的是( )
| A.pH=5的NaHSO3溶液:c(HSO3-) > c(SO32-)> c(H2SO3) |
| B.pH=3的盐酸跟pH=11的氨水等体积混合: c(H+)>c(OH-) |
| C.pH<7的CH3COONa和CH3COOH的混合溶液 c(Na+)> c(CH3COO-)> c(H+)>c(OH-) |
| D.pH=12的NaOH溶液中:c(OH-)水电离=1.0×10-12 mol/L |
水的电离过程为H2O H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
| A.c(H+)随着温度的升高而降低 |
| B.35 ℃时c(H+)>c(OH-) |
| C.35 ℃时的水比25 ℃时的水电离程度小 |
| D.水的电离是个吸热过程 |
等物质的量浓度、等体积的下列溶液中:
①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3、⑤(NH4)2CO3,下列关系或者说法正确的是( )
| A.c(CO32—)的大小关系为:②>⑤>③>④>① |
| B.c(HCO3—)的大小关系为:④>③>⑤>②>① |
| C.将溶液蒸干灼烧后只有①不能得到对应的固体物质 |
| D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应 |
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是( )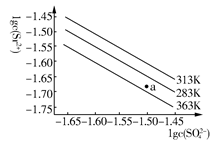
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
在温度相同、浓度相同的条件下,下列六种物质的水溶液的pH由小到大的排列顺序如图所示。
图中①②③可能是( )
| A.NH4NO3、(NH4)2SO4、CH3COONa |
| B.(NH4)2SO4、NH4Cl、C6H5ONa |
| C.(NH4)2SO4、NH4NO3、Na2CO3 |
| D.(NH4)2SO4、NH4NO3、CH3COONa |
下列说法正确的是 ( )
| A.0.1 mol·L-1的醋酸加水稀释,c(H+)/c(OH-)减小 |
| B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大 |
| D.V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项正确的是 ( )。
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.等浓度的HCOONa和NaCN溶液的pH前者大于后者
D.中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者