题目内容
某R元素的单质1.35 g与足量稀硫酸充分反应生成R2(SO4)3和1.68 L氢气(标准状况),求R的相对原子质量。若R元素原子核内有14个中子,请写出该核素的符号。
解析:本题通过由化学方程式求算元素原子的相对原子质量,巩固了原子结构的知识。
设R的相对原子质量为x,
![]()
2R+3H2SO4====R2(SO4)3+3H2↑
2x 3 mol
1.35 g 0.075 mol
2x∶1.35 g=3 mol∶0.075 mol
解得x=27 g
根据质量数=质子数+中子数,可求得该元素的质子数为:27-14=13,为铝元素。
答案:![]()

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
(15分)下表是元素周期表的一部分,用元素符号或化学式回答下列问题:
|
主族周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
1 |
|
|
|
|
|
|
|
① |
|
2 |
|
|
|
|
② |
③ |
④ |
|
|
3 |
⑤ |
⑥ |
⑦ |
|
⑧ |
⑨ |
⑩ |
|
(1)在这些元素中_______是最活泼的金属元素;其氢氧化物具有两性的元素是
(2)这些元素的最高价氧化物对应的水化物中酸性最强的物质的化学式_________
(3)从⑤到⑩元素中_______原子半径最小。
(4)最不活泼的元素的单质的化学式是 。若该元素某核素原子核内中子数与质子数相等,则该核素的摩尔质量是
(5)用电子式表示⑩、⑥两元素形成化合物的过程
(6)与元素⑨非金属性强弱最接近的元素是
(7)根据下表判断:最接近磷原子半径R(10-10m)的取值范围的是
|
元 素 |
N |
S |
O |
Si |
|
原子半径/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |


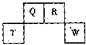 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: