题目内容
科学家利用Na2CO3溶液的喷淋捕捉空气中的CO2,设计技术流程如图1.
请回答下列问题:
(1)Na2CO3溶液喷成雾状的目的是 .
(2)在500℃的反应炉中发生反应的化学方程式为 .
(3)在整个流程中,可以循环利用的物质是 .
(4)为研究合成塔反应的最佳条件,在10L密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
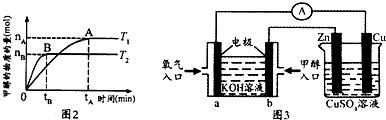
①对于图2实验结果(注:T1、T2均大于300℃)说法正确的是 (填序号).
a.向密闭容器中不断补充CO2,H2转化率增大
b.该反应在T1时的平衡常数比T2时小
c.温度为T1时,从反应开始到平衡,H2的平均速率为v(H2)=
mol.L-1?min-1
d.平衡处于A点时密闭容器温度从T1变到T2,
增大
②300℃时,若充入1mol CO2和3mol H2,从反应开始到平衡,测得CO2的转化率为75%.则平衡常数K为
L2?mol-2(用最简分数表示).
(5)将制备的甲醇用于图3装置.当铜片的质量变化为19.2g时,a极上消耗的O2在标准状况下的体积为 L.

请回答下列问题:
(1)Na2CO3溶液喷成雾状的目的是
(2)在500℃的反应炉中发生反应的化学方程式为
(3)在整个流程中,可以循环利用的物质是
(4)为研究合成塔反应的最佳条件,在10L密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).

①对于图2实验结果(注:T1、T2均大于300℃)说法正确的是
a.向密闭容器中不断补充CO2,H2转化率增大
b.该反应在T1时的平衡常数比T2时小
c.温度为T1时,从反应开始到平衡,H2的平均速率为v(H2)=
| nA |
| tA |
d.平衡处于A点时密闭容器温度从T1变到T2,
| n(H2) |
| n(CH3OH) |
②300℃时,若充入1mol CO2和3mol H2,从反应开始到平衡,测得CO2的转化率为75%.则平衡常数K为
(5)将制备的甲醇用于图3装置.当铜片的质量变化为19.2g时,a极上消耗的O2在标准状况下的体积为
考点:性质实验方案的设计,化学电源新型电池,化学平衡的影响因素
专题:实验设计题,基本概念与基本理论
分析:(1)喷成雾状可增大与二氧化碳的接触面积,增大反应速率;
(2)由转换关系图可知,在500℃的反应炉中碳酸氢钠分解变成碳酸钠和水及二氧化碳;
(3)从流程图中找出循环的物质;
(4)①a.增大一种反应物浓度能提高另一种反应物转化率;
b.根据温度变化对平衡的影响,可判断平衡常数的大小;
c.根据v=
判断;
d.根据温度对平衡的影响,可判断出平衡移动的方向,据此再判断物质的量的变化;
②根据平衡三段式列式计算;
(5)依据原理分析写出电极反应,结合电子守恒计算.
(2)由转换关系图可知,在500℃的反应炉中碳酸氢钠分解变成碳酸钠和水及二氧化碳;
(3)从流程图中找出循环的物质;
(4)①a.增大一种反应物浓度能提高另一种反应物转化率;
b.根据温度变化对平衡的影响,可判断平衡常数的大小;
c.根据v=
| △c |
| △t |
d.根据温度对平衡的影响,可判断出平衡移动的方向,据此再判断物质的量的变化;
②根据平衡三段式列式计算;
(5)依据原理分析写出电极反应,结合电子守恒计算.
解答:
解:(1)喷成雾状可增大与二氧化碳的接触面积,增大反应速率;
故答案为:使反应充分发生或提高反应速率;
(2)由转换关系图可知,在500℃的反应炉中碳酸氢钠分解变成碳酸钠和水及二氧化碳,反应方程式为:2NaHCO3
Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(3)从流程图中可知,碳酸氢钠分解后生成碳酸钠又循环使用,
故答案为:碳酸钠;
(4)①a.增大二氧化碳浓度反应正向进行,氢气的转化率增大,故a正确;
b.因为反应从T1变到T2,n(CH3OH)变小,即平衡逆向移动,所以T1时的平衡常数比T2时的大,故b错误;
c.根据v=
可知,速率为单位时间内浓度变化,而不是物质的量的变化,故c错误;
d.由图象可知,A点的反应体系从T1变到T2,n(CH3OH)变小,即平衡逆向移动,所以
增大
增大,故d正确;
故选:ad.
②在300℃时,将1mol CO2和 3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为75%,则
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol)0.75 2.25 0.75 0.75
平衡量(mol)0.25 0.75 0.75 0.75
平衡量(mol/L)0.025 0.075 0.075 0.075
K=
=
;
故答案为:
;
(5)当铜片的质量变化为19.2g时物质的量=
=0.3mol,依据电极反应和电子守恒计算得到,铜电极电极反应:Cu-2e-=Cu2+;
a电极反应为;O2+2H2O+4e-=4OH-,依据电子守恒得到,O2~2Cu,a极上消耗的O2物质的量为0.15mol,标准状况下的体积=0.15mol×22.4L/mol=3.36L,
故答案为:3.36.
故答案为:使反应充分发生或提高反应速率;
(2)由转换关系图可知,在500℃的反应炉中碳酸氢钠分解变成碳酸钠和水及二氧化碳,反应方程式为:2NaHCO3
| ||
故答案为:2NaHCO3
| ||
(3)从流程图中可知,碳酸氢钠分解后生成碳酸钠又循环使用,
故答案为:碳酸钠;
(4)①a.增大二氧化碳浓度反应正向进行,氢气的转化率增大,故a正确;
b.因为反应从T1变到T2,n(CH3OH)变小,即平衡逆向移动,所以T1时的平衡常数比T2时的大,故b错误;
c.根据v=
| △c |
| △t |
d.由图象可知,A点的反应体系从T1变到T2,n(CH3OH)变小,即平衡逆向移动,所以
| n(H2) |
| n(CH3OH) |
增大,故d正确;
故选:ad.
②在300℃时,将1mol CO2和 3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为75%,则
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol)0.75 2.25 0.75 0.75
平衡量(mol)0.25 0.75 0.75 0.75
平衡量(mol/L)0.025 0.075 0.075 0.075
K=
| 0.075×0.075 |
| 0.025×0.0753 |
| 1600 |
| 3 |
故答案为:
| 1600 |
| 3 |
(5)当铜片的质量变化为19.2g时物质的量=
| 19.2g |
| 64g/mol |
a电极反应为;O2+2H2O+4e-=4OH-,依据电子守恒得到,O2~2Cu,a极上消耗的O2物质的量为0.15mol,标准状况下的体积=0.15mol×22.4L/mol=3.36L,
故答案为:3.36.
点评:本题考查了热化学方程式书写,原电池原理和电解池原理的分析应用,化学平衡的计算方法,平衡常数概念理解计算,题目难度中等.

练习册系列答案
相关题目
关于1molH2O的说法正确的是( )
| A、质量18g |
| B、体积22.4L |
| C、分子数为1 |
| D、含有O原子的物质的量为2mol |
摩尔是( )单位.
| A、质量 | B、密度 |
| C、相对分子质量 | D、物质的量 |
石灰石是许多工业的原料之一,但制取下列物质时不需用石灰石的是( )
| A、制硅 | B、制水泥 |
| C、制玻璃 | D、制生石灰 |
下列实验操作或装置(略去部分加持仪器)正确的是( )
A、 中和滴定 |
B、 配制溶液 |
C、 乙酸乙酯的制备 |
D、 制取收集干燥氨气 |
下列反应的离子方程式正确的是( )
| A、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、向次氯酸钙溶液中通入过量二氧化硫:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D、向碘化亚铁溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |

 研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.
研究氮的氧化物、硫的氧化物、碳的氧化物等大气污染物的处理具有重要意义.