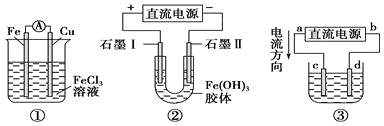
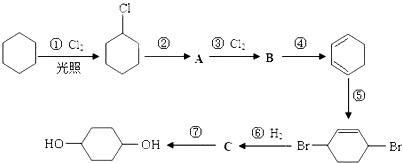
题目内容
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
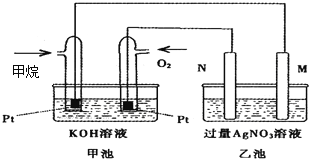
(1)M电极的材料是__________,其电极名称是_____________。
(2)N的电极反应式为____________________________,通入甲烷的电极反应式为______________________________________________,
(3)乙池总反应的化学方程式是_______________________________________________,
(4)在此过程中,乙池中某一电极析出金属银4.32g,甲池中理论上消耗氧气为_____mL(标准状况下),若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为__________.
【答案】 铁 阴极 ![]()
![]()
![]() 224mL 0.1mol·L-1
224mL 0.1mol·L-1
【解析】分析:甲池中两电极分别通入甲烷和氧气,属于甲烷燃料电池,因此乙池是电解池。甲烷在负极通入,氧气在正极通入,因此M电极是阴极,N电极是阳极,据此解答。
详解:(1)根据以上分析可知M是阴极,N是阳极,由于乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,所以M电极的材料是铁,其电极名称是阴极,溶液中的银离子放电。
(2)N是石墨,作阳极,溶液中的氢氧根离子放电,则电极反应式为4OH――4e-=O2↑+2H2O;甲池溶液显碱性,则通入甲烷的电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
(3)根据以上分析可知乙池总反应的化学方程式是4AgNO3+2H2O![]() 4HNO3+4Ag+O2↑;
4HNO3+4Ag+O2↑;
(4)n(Ag)=4.32g÷108g/mol=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=1/4×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=2.24L=224mL;乙电池发生反应:4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,转移0.04mol电子,生成氢离子物质的量为0.04mol,若此时乙池溶液的体积为400 mL,则乙池中溶液的H+的浓度为0.04mol÷0.4L=0.1 mol·L-1。
4Ag+4HNO3+O2↑,转移0.04mol电子,生成氢离子物质的量为0.04mol,若此时乙池溶液的体积为400 mL,则乙池中溶液的H+的浓度为0.04mol÷0.4L=0.1 mol·L-1。

【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是

选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
B | NaCl | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
A. A B. B C. C D. D