题目内容
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是
- A.阳极反应为Fe-2e-=Fe2+
- B.电解过程中溶液pH不会变化
- C.过程中有Fe(OH)3沉淀生成
- D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原
B
由题干信息可知其反应原理为:阳极(Fe):Fe―2e—=Fe2+;阴极(Fe):2H++2e-=H2↑,因H+不断在阴极上得电子成为H2而析出,且Cr2O72-与Fe2+的反应也在消耗H+,使得溶液由酸性变为中性,再由中性变为碱性,Cr3++3OH—=Cr(OH)3↓, Fe3++3OH—=Fe(OH)3↓,所以A、C项正确,B不正确。D项,由阳极反应及总反应知,电路中每转移12mol电子,则生成6molFe2+,所以有1molCr2O72-被还原,D正确。
考点定位:考查电解原理的应用。解题关键是金属铁作阳极,参与电极反应,生成的Fe2+使Cr2O72-被还原。难度较大。
由题干信息可知其反应原理为:阳极(Fe):Fe―2e—=Fe2+;阴极(Fe):2H++2e-=H2↑,因H+不断在阴极上得电子成为H2而析出,且Cr2O72-与Fe2+的反应也在消耗H+,使得溶液由酸性变为中性,再由中性变为碱性,Cr3++3OH—=Cr(OH)3↓, Fe3++3OH—=Fe(OH)3↓,所以A、C项正确,B不正确。D项,由阳极反应及总反应知,电路中每转移12mol电子,则生成6molFe2+,所以有1molCr2O72-被还原,D正确。
考点定位:考查电解原理的应用。解题关键是金属铁作阳极,参与电极反应,生成的Fe2+使Cr2O72-被还原。难度较大。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
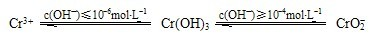

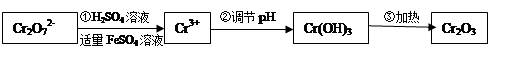
 ·y
·y O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(

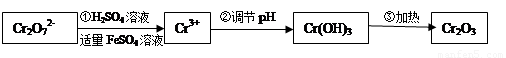
 ·y
·y O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol
FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol
FeSO4·7H2O则复合氧化物(
