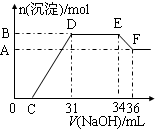
题目内容
将3.25g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。
求:(1)反应中生成的H2在标准状况下的体积;
(2)所用盐酸中HCl的物质的量浓度。
1.12L;0.5mol/L
解析试题分析:n(Zn)=3.25g÷65g/mol=0.05mol,则根据反应式可知
Zn + 2HCl ="=" ZnCl2 + H2↑
1 mol 2 mol 1 mol
0.05mol 0.1mol 0.05mol
所以V(H2)=0.05mol ×22.4L/mol ="=" 1.12L
c(HCl)= 0.1mol÷0.2L=0.5mol /L
考点:考查物质的量的有关计算

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: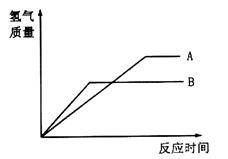
(1)在Fe、Zn、Cu中,A是__________,B是____________。
(2)将两种金属粉末按一定比例混合后,进行甲、乙、丙三组实验,三组实验各取500mL同浓度的盐酸加入该种混合粉末,有关数据如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 混合粉末质量/g | 6.2 | 18.6 | 24.8 |
| 生成气体体积(标准状况下)/mL | 2240 | 5600 | 5600 |
计算上述所用盐酸的物质的量浓度(写出计算过程)中。