题目内容
已知:H2(g)+ O2(g)= H2O(g) △H=-Q1kJ·mol-1 2H2(g)+O2(g)=2H2O(l) △H= - Q2kJ·mol-1 则下列判断正确的是
O2(g)= H2O(g) △H=-Q1kJ·mol-1 2H2(g)+O2(g)=2H2O(l) △H= - Q2kJ·mol-1 则下列判断正确的是
 O2(g)= H2O(g) △H=-Q1kJ·mol-1 2H2(g)+O2(g)=2H2O(l) △H= - Q2kJ·mol-1 则下列判断正确的是
O2(g)= H2O(g) △H=-Q1kJ·mol-1 2H2(g)+O2(g)=2H2O(l) △H= - Q2kJ·mol-1 则下列判断正确的是 [ ]
A.2Q1>Q2
B.Q1>2Q2
C.2Q1<Q2
D.Q2= Q1
Q1
B.Q1>2Q2
C.2Q1<Q2
D.Q2=
 Q1
Q1C

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”).
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”). O
O PtF(g) ΔH2=-771.1 kJ·mol-1
PtF(g) ΔH2=-771.1 kJ·mol-1 O
O O
O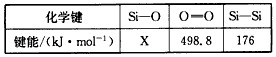
 (1)已知:
(1)已知: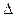 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1
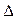 H3="482.2" kJ·mol-1
H3="482.2" kJ·mol-1  J。该反应的热化学方程式为________。
J。该反应的热化学方程式为________。