题目内容
【题目】如图是一个电化学过程的示意图,回答下列问题:
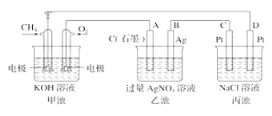
(1)甲池将__________能转化为__________能,乙装置中电极A是__________极。
(2)甲装置中通入CH4一极的电极反应式为 __________
(3)一段时间,当丙池中产生112 mL(标准状况)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=__________(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入__________(写化学式)。
【答案】 化学 电 阳 CH4+10OH - - 8e- = CO32- +7H2O 12 HCl
【解析】(1)甲池为甲烷形成的燃料电池;根据原电池的正负极判断电解池的阴阳极;
(2)CH4在负极上失电子,碱性条件下生成碳酸根;
(3)电解氯化钠溶液时,阴极上氢离子放电,阳极上氯离子放电,根据氯气和氢氧化钠的关系式计算氢氧化钠的物质的量浓度,从而得出溶液的pH;根据电解的产物分析,根据“析出什么元素加入什么元素”的原则确定加入的物质。
(1)甲池中一极通入甲烷,另一极通入氧气,所以甲池为甲烷形成的燃料电池,原电池是将化学能转化为电能的装置;通入甲烷的一极为负极,通入氧气的一极为正极,A与正极相连,所以A为阳极,故答案为:化学;电;阳;
(2)CH4在负极上失电子,碱性条件下生成碳酸根,所以甲装置中通入CH4的电极反应式为CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
(3)设电解后氢氧化钠的物质的量浓度是x,丙池中产生112mL,则氢气的体积与氯气的体积相同均为56mL,即0.056L,
2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH,
H2↑+Cl2↑+2NaOH,
22.4L 2mol
0.056L x×0.5L
则x=![]() =0.01mol/L,则c(H+)=10-12 mol/L,所以溶液的pH=12,由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,故答案为:12;HCl。
=0.01mol/L,则c(H+)=10-12 mol/L,所以溶液的pH=12,由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,故答案为:12;HCl。