题目内容
工业上冶炼金属铁的主要反应为:Fe2O3+3CO
2Fe+3CO2.其中,Fe2O3
| ||
被还原
被还原
( 填“被氧化”或“被还原”),CO作还原剂
还原剂
(填“氧化剂”或“还原剂”).在该反应中,若消耗了1mol Fe2O3,则生成2
2
mol Fe.分析:根据元素化合价的变化判断氧化剂和还原剂,结合氧化还原反应中氧化剂和还原剂之间得失电子数目相等计算.
解答:解:反应中Fe元素的化合价降低,则Fe2O3被还原,为氧化剂,C元素的化合价升高,CO为还原剂,
根据反应的方程式可知,若消耗了1mol Fe2O3,则生成2molFe,
故答案为:被还原;还原剂;2.
根据反应的方程式可知,若消耗了1mol Fe2O3,则生成2molFe,
故答案为:被还原;还原剂;2.
点评:本题考查氧化还原反应,题目难度不大,本题注意从化合价的变化的角度进行判断.

练习册系列答案
相关题目
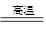 2Fe + 3CO2
2Fe + 3CO2