题目内容
下列说法错误的是( )
| A、H2O2和Na2O2都属于氧化物,两种物质中所含的化学键类型完全相同 | B、原子核外在离核较远区域的电子易失去,其原因是这些电子能量较高 | C、第三周期非金属元素形成氢化物的稳定性从左到右逐渐增强 | D、在周期表的金属元素和非金属元素的交界处寻找半导体,在过渡元素区中寻找催化剂 |
分析:A.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;
B.离原子核越远的电子其能量越大,原子核对其吸引力越小;
C.非金属性越强的元素其氢化物越稳定;
D.在元素周期表的金属元素和非金属元素的交界处寻找半导体,可以用于做催化剂的元素种类较多,一般为过渡金属元素.
B.离原子核越远的电子其能量越大,原子核对其吸引力越小;
C.非金属性越强的元素其氢化物越稳定;
D.在元素周期表的金属元素和非金属元素的交界处寻找半导体,可以用于做催化剂的元素种类较多,一般为过渡金属元素.
解答:解:A.双氧水中只含共价键,过氧化钠中既含离子键又含共价键,故A错误;
B.原子核外在离核较远区域的电子易失去,其原因是这些电子能量较高,原子核对其吸引力小,故B正确;
C.第三周期非金属元素从左到右非金属性逐渐增强,所以其形成氢化物的稳定性从左到右逐渐增强,故C正确;
D.在金属元素与非金属元素的分界线附近的元素,通常既具有金属性又具有非金属性,可以找到半导体材料,可以用于做催化剂的元素种类较多,一般为过渡金属元素,故D正确;
故选A.
B.原子核外在离核较远区域的电子易失去,其原因是这些电子能量较高,原子核对其吸引力小,故B正确;
C.第三周期非金属元素从左到右非金属性逐渐增强,所以其形成氢化物的稳定性从左到右逐渐增强,故C正确;
D.在金属元素与非金属元素的分界线附近的元素,通常既具有金属性又具有非金属性,可以找到半导体材料,可以用于做催化剂的元素种类较多,一般为过渡金属元素,故D正确;
故选A.
点评:本题考查化学键的判断、非金属性强弱的判断、元素周期表的应用等知识点,明确非金属非金属性强弱的判断方法,为考试热点,难度不大.

练习册系列答案
相关题目
下列说法错误的是( )
| A、C2H4和C4H8一定都能使溴水退色 | B、C2H6和C4H10一定是同系物 | C、C3H6不只表示一种物质 | D、烯烃中各同系物中碳的质量分数相同 |
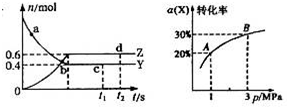 (2013?枣庄二模)一定温度下的密闭容器中发生反应:X(g)+3Y(g)f?2Z(g)△H<0,如图是反应达平衡及改变条件平衡移动的图象.下列说法错误的是( )
(2013?枣庄二模)一定温度下的密闭容器中发生反应:X(g)+3Y(g)f?2Z(g)△H<0,如图是反应达平衡及改变条件平衡移动的图象.下列说法错误的是( )