题目内容
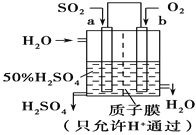
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹) 。

(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。①若在丙中加入适量水,即可制得氯水。将所得氯水进行实验,实验操作、现象、结论如下:
实验操作 | 现 象 | 结 论 |
氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气和水反应的产物具有酸性 |
实验的结论是否合理__________,(选填合理或不合理)请说明理由______________________。请利用上述装置设计一个简单的实验验证Cl-和S2-的还原性强弱,则甲、乙、丙中盛放的试剂是甲__________________ 乙__________________ 丙__________________
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是:___________________________________使试管中的气体逸出,NO2与水接触后即可引发烧杯中的水进入试管丁。
【答案】不合理 制取的氯气中含有氯化氢,溶于水遇碳酸氢钠粉末有气泡 浓盐酸 MnO2 硫化钠溶液 ab c 双手紧握(或微热)试管丁
【解析】
(1)用二氧化锰和浓盐酸加热制备的氯气中混有氯化氢气体,据此分析解答;可根据反应Cl2+S2- =2Cl- +S↓设计实验验证Cl-和S2-的还原性强弱;
(2)浓硝酸具有强氧化性,与铜反应生成二氧化氮气体收集在丁中,NO2能够与水反应,使得气体压强减小,结合装置D的特征分析解答。
(1)根据图示,A装置制备的氯气中含有HCl气体,HCl气体溶于水就是盐酸,盐酸能够与碳酸氢钠粉末反应生成二氧化碳气体,在实验中没有进行除杂,不能说明氯气和水反应的产物具有酸性;要验证Cl-和S2-的还原性强弱,可根据反应Cl2+S2- =2Cl- +S↓设计实验,在A装置中,生成的气体通入到装有硫化钠溶液的中,在C中盛放硫化钠溶液,如试管中溶液由无色变为淡黄色浑浊,即可证明氯气的氧化性强于硫,则S2-的还原性强于Cl-,故答案为:不合理;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;浓盐酸;MnO2;硫化钠溶液;
(2)浓硝酸具有强氧化性,与铜反应生成二氧化氮气体,反应的化学方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;浓硝酸与铜反应生成的二氧化氮收集于试管丁中,要验证NO2与水的反应,要先关闭a、b,打开止水夹c,然后用微热法使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁中,故答案为:ab;c;双手紧握(或微热)试管丁。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
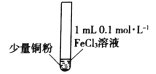
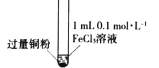
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀