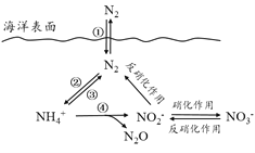
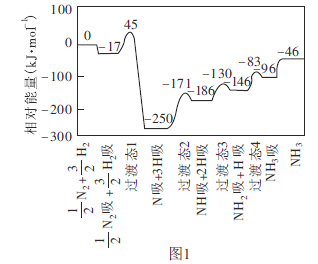
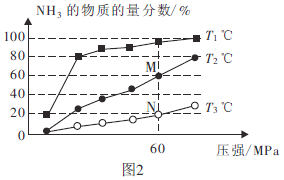
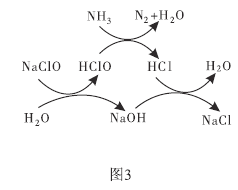
题目内容
【题目】现有部分元素的性质与原子(或分子)结构如下表:

(1)写出元素T的原子结构示意图___。
(2)元素Y与元素Z相比,金属性较强的是__(用元素符号表示),下列表述中能证明这一事实的是___(填序号)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质剧烈
D.Y最高价氧化物的水化物的碱性比Z的强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物,写出该化合物的化学式___,该化合物与二氧化碳反应的化学方程式为___。
【答案】![]() Na CD Na2O2 2Na2O2+2CO2=2Na2CO3+O2
Na CD Na2O2 2Na2O2+2CO2=2Na2CO3+O2
【解析】
由表中信息可知:T为氧元素,X为氮元素,Y为钠元素,Z为铝元素,据此回答。
由表中信息可知:T为氧元素,X为氮元素,Y为钠元素,Z为铝元素。
(1)写出元素T的原子结构示意图![]() ,故答案为:
,故答案为:![]() ;
;
(2)Na比Al金属性强;
A.Y单质的熔点比Z单质低,熔点与金属性无关,故A错误;
B.Y的化合价比Z低,化合价高低与金属性无关,故B错误;
C.Y单质与水反应比Z单质剧烈,则Y金属性比Z强,故C正确;
D.Y最高价氧化物的水化物的碱性比Z的强,则Y金属性比Z强,故D正确;
故答案为:Na;CD;
(3)T、X、Y、Z中有两种元素能形成既有离子键又有共价键的化合物为Na2O2该化合物与二氧化碳反应的化学方程式为![]() ,故答案为:Na2O2;
,故答案为:Na2O2;![]() 。
。

【题目】中国医药学是一个伟大的宝库。古代制取下列药物过程中未发生氧化还原反应的是( )
A | 《本草纲目》:制取“玄明粉”( | 以芒硝于风日中消尽水气,自成轻飘白粉也 |
B | 《通玄秘术》:制取“华盖丹”(醋酸铅) | 以铁筋穿作窍,以绳子穿之;用净瓷瓮子盛米醋1斗,将铅片子悬排于瓮子口…… |
C | 《本草蒙筌》:制取“灵砂”(硫化汞) | 水银一两,硫黄六铢,先炒作青砂头,后入水火炉抽之…… |
D | 《本草图经》:制取“铁华粉”(醋酸亚铁) | 以铁拍做段片,置醋糟中,积久衣生…… |
A.AB.BC.CD.D