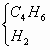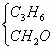题目内容
标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧.若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g.
(1)计算燃烧产物中水的质量.
(2)若原气体是单一气体,通过计算推断它的分子式.
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组).
答案:
解析:
解析:
|
答案:(1)2.79 (2)C2H4 (3)C4H6和H2(或C3H8和CO,C3H6和CH2O等) 思路解析:(1)m(CO2)=15.0 g×44 g·mol-1/100 g·mol-1=6.6 g m(CO2+H2O)=9.3 g m(H2O)=9.3 g-6.6 g=2.7 g (2)n(CO2)=6.6 g/44 g·mol-1=0.15 mol n(H2O)=2.7 g/189 g·mol-1=0.15 mol N(C)∶N(H)=1∶2 n(无色可燃气体)=1.68 L/22.4 L·mol-1=0.075 mol 分子中的C原子数=0.15 mol/0.075 mol=2 H原子数=2×2=4 (3)因为单一气体为C2H4,现为等物质的量的两种混合气体之混合物. 所以,2 mol混合气体中,应含4 mol C原子,8 mol H. 所以,此两种混合物为 |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目