��Ŀ����
��7�֣���֪�����Ȼ�ѧ����ʽ��
��H2(g)+1/2O2(g)=H2O(l) ��H= ��285 kJ/mol
��H2(g)+1/2O2(g)=H2O(g) ��H= ��241.8 kJ/mol
��C(s)+1/2O2(g)=CO(g) ��H= ��241.8 kJ/mol
��C(s)+O2(g)=CO2(g) ��H= ��393.5 kJ/mol
�ش��������⣺
��1��������Ӧ�����ڷ��ȷ�Ӧ����_________________��
��2��H2��ȼ����Ϊ___________��C��ȼ����Ϊ___________��
��3��ȼ��10 g H2����Һ̬ˮ���ų�������Ϊ__________________��
��4��CO��ȼ����Ϊ______________�����Ȼ�ѧ����ʽΪ______________________��
���𰸡�

����������

��ϰ��ϵ�д�
�����Ŀ
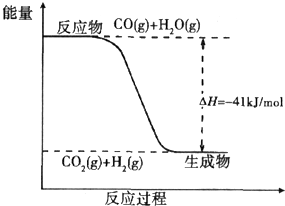 ú̿����ת��Ϊ�����Դ�ͻ���ԭ�ϣ�
ú̿����ת��Ϊ�����Դ�ͻ���ԭ�ϣ�