题目内容
6.对于反应:S(s)+O2(g)?SO2(g),可使反应速率增大的措施是( )①增大压强②升高温度③通入O2④增加硫的量⑤降低压强.
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
分析 该反应是一个反应前后气体体积不变的可逆反应,升高温度、增大压强、增大反应物浓度、加入催化剂等都可以增大反应速率,据此分析解答.
解答 解:①增大压强,单位体积内活化分子数增大,所以反应速率增大,故正确;
②升高温度,增大活化分子百分数,所以反应速率增大,故正确;
③通入O2,单位体积内活化分子数增大,所以反应速率增大,故正确;
④增加硫的量,不影响活化分子百分数或活化分子数,所以不影响反应速率,故错误;
⑤降低压强,降低单位体积内活化分子数,所以反应速率降低,故错误;
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,可以通过改变浓度、温度等方法改变反应速率,注意:固体或纯液体的物质的量多少不影响反应速率,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列有关化学用语表示正确的是( )
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: | |
| C. | 乙醇的分子式:C2H4O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{153}$I |
17.一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到平衡的标志是( )
| A. | 单位时间内生成n mol X,同时消耗3n molY | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的物质的量分数均保持不变 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
14.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 80g CuO和Cu2S的混合物含有铜原子数一定为NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 1mol铁与1molCl2充分反应,转移电子数为3NA | |
| D. | 向含有FeI2的溶液中通入适量氯气,当有1mol Fe2+被氧化时该反应转移电子的数目至少为NA |
1.下列物质属于同位素的一组是( )
| A. | 1H和3H | B. | 淀粉和纤维素 | ||
| C. | O2与O3 | D. | CH4与CH3-CH2-CH3 |
11.下表为元素周期表短周期的一部分,下列有关X、Y、Z、W四种元素的叙述正确的是( )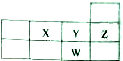

| A. | 原子半径大小:W>Y>X | B. | 核电荷数:W>Z>Y>X | ||
| C. | W的氧化物对应的水化物为强酸 | D. | X是ⅥA族元素,其最高化合价为+6价 |
18.化学与生活联系紧密,下列说法正确的是( )
| A. | 食品包装袋中常用生石灰做食品的防腐剂 | |
| B. | 硫酸钙溶液不能使豆浆中的蛋白质发生聚沉而制取豆腐 | |
| C. | 金属钠着火可用碳酸氢钠干粉灭火器灭火 | |
| D. | “84消毒液”具有强氧化性,可以杀死流感病毒 |
15.下列说法正确的是( )
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比溴化氢的沸点高 | |
| D. | Li、Na、K单质的熔点逐渐升高 |
16.下列各组离子,在强碱性溶液中可以大量共存的是( )
| A. | Na+、Ba2+、Cl-、SO42- | B. | Na+、Ba2+、AlO2-、NO3- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Na+、K+、NO3-、SiO32- |