题目内容
17.A、B、C、D 4种元素的原子序数均小于18,其最高正价数依次为+1、+4、+5、+7,已知B的原子核外次外层电子数为2.A、C、D原子的核外次外层电子数为8.(1)A的离子结构示意图为
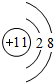 ,BD4的电子式为
,BD4的电子式为 .
.(2)比较C、D的气态氢化物的稳定性:HCl>PH3(写化学式)
(3)A、B的氧化物均不止一种,写出它们的氧化物互相反应生成一种气体的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
分析 A、B、C、D四种元素的原子序数均小于18,B的原子核外次外层电子数为2,即B原子核外有2个电子层,最高正化合价为+4,故B为碳元素;A、C、D原子的核外次外层电子数为8,均处于第三周期,最高正化合价依次为+1、+5、+7,故A为Na、C为P元素、D为Cl,据此解答.
解答 解:A、B、C、D四种元素的原子序数均小于18,B的原子核外次外层电子数为2,即B原子核外有2个电子层,最高正化合价为+4,故B为碳元素;A、C、D原子的核外次外层电子数为8,均处于第三周期,最高正化合价依次为+1、+5、+7,故A为Na、C为P元素、D为Cl.
(1)A为钠元素,则钠离子的质子数为11,核外电子数为10,有2个电子层,最外层电子数为8,其离子结构示意图为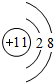 ;CCl4的电子式为
;CCl4的电子式为 ,
,
故答案为: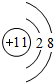 ;
; ;
;
(2)非金属性Cl>P,故氢化物稳定性:HCl>PH3,故答案为:HCl;PH3;
(3)Na、C的氧化物均不止一种,它们的氧化物互相反应生成一种气体,应是过氧化钠与二氧化碳反应生成碳酸钠与氧气,反应化学方程式:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查位置结构性质的关系,注侧重对化学用语的考查,利用已知信息推出各元素是解答本题的关键,题目难度不大,注意四氯化碳电子式的书写,容易漏掉孤电子对而导致错误.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.放射性元素钚(Pu)有20种放射性同位素,下列关于${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu都含有94个中子 | |
| B. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu互为同位素 | |
| C. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu的核外电子数不同 | |
| D. | ${\;}_{94}^{240}$Pu和${\;}_{94}^{241}$Pu分别含有146和147个质子 |
8.用下图所示装置及药品进行相应实验,能达到实验目的是( )
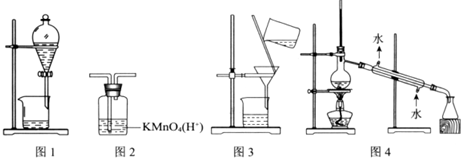

| A. | 图1 分离乙醇和乙酸 | B. | 图2 除去乙炔中的乙烯 | ||
| C. | 图3 除去溴苯中的溴单质 | D. | 图4 除去工业酒精中的甲醇 |
12.最近科学界合成一种“二重结构”的球形物质分子,是把足球型的C60分子融进足球型的Si60分子中,外面的Si原子与里面的C原子结合,下列关于这种物质的叙述中正确的是( )
| A. | 是两种单质的混合物 | B. | 是共价化合物 | ||
| C. | 该新物质硬度很大 | D. | 含有离子键 |
2.常温下,下列各组物质相混合不能产生气体的是( )
| A. | 铁与浓硫酸 | B. | 铁与稀硫酸 | ||
| C. | 铝与氢氧化钠溶液 | D. | 大理石与盐酸 |
9. 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | 图中x点的坐标为(100,6) | |
| C. | 若升高温度,图象会发生变化 | |
| D. | 把0.1mol•L-1的NaCl换成0.1mol•L-1 NaI则图象在终点后变为虚线部分 |
15.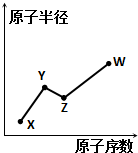 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应 | |
| C. | X、W可形成离子化合物XW | |
| D. | X、Z、W形成的化合物均为强酸 |
16.阿伏加德罗常数常用NA表示,下列说法中正确的是( )
| A. | 1 mol乙烷中含有C-H的键数为3NA | |
| B. | 1 mol甲基(-CH3)所含电子数为9 NA | |
| C. | 标准状况下,11.2L 四氯化碳所含分子数为0.5 NA | |
| D. | 1.6g 甲烷与足量氯气反应生成CCl4,转移的电子数为0.4 NA |
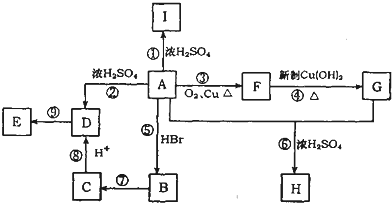
 .
. ;写出反应⑦的化学方程式:
;写出反应⑦的化学方程式: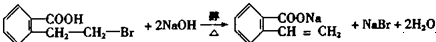 .
.