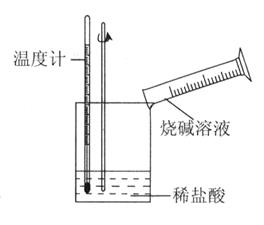
��Ŀ����
�������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��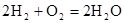 ��
��
��1��Ϊ�˼ӿ�����Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��________������ţ���ͬ����
| A��ʹ�ô��� | B���ʵ����������Ũ�� |
| C���ʵ���߷�Ӧ���¶� | D���ʵ����ͷ�Ӧ���¶� |
��3���Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯��
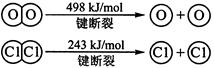
�����ϡ��ټ��ܣ���1mol��ѧ����Ҫ���յ������������γ�1mol��ѧ�����ų���������Ϊ���ܡ�
�ڻ�ѧ���ļ��ܣ�
| ��ѧ�� | H��H | O��O | H��O |
����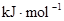 | 436 | 496 | 463 |
��������
| ��ѧ�� | ����������� �ų������� | �����仯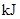 | |
| ��ѧ�� | 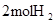 �еĻ�ѧ�� �еĻ�ѧ�� | _______________ | _______________ |
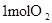 �еĻ�ѧ�� �еĻ�ѧ�� | |||
| �γɻ�ѧ�� |  �� �� | _______________ | _______________ |
| �������仯 | _______________ | _______________ | |
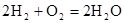 �����У�������________�������������������________��Ӧ�����������ԭ��������·��ÿת��0��2mol���ӣ���״��������H2�������________L��
�����У�������________�������������������________��Ӧ�����������ԭ��������·��ÿת��0��2mol���ӣ���״��������H2�������________L��
��1��ABC ��2��A
��3����ѧ�� ����ա��ų������� �����仯��kJ�� ��ѧ�� 2molH2�еĻ�ѧ�� �������� 1368 1molO2�еĻ�ѧ�� �γɻ�ѧ�� 4molH-O�� �ų����� 1852 �������仯 �ų����� 484
��4���� ���� 2��24
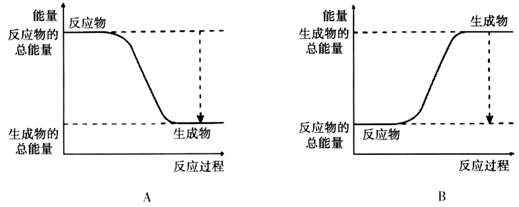
���������������1��A��B��C��Ϊ����Ӧ���ʵķ�����DΪ��С��Ӧ���ʡ�
��2���÷�ӦΪ���ȷ�Ӧ����Ӧ����������������������������
��3������2molH2��Ҫ����2mol��436KJ/mol=872KJ������1molO2��Ҫ����1mol��496KJ/mol=496KJ
����Ҫ����872KJ+496KJ=1368KJ�������γ�4molH-O���ܹ��ų�4mol��463KJ/mol=1852KJ�����������仯Ϊ1852KJ-1368KJ=484KJ��
��4��H2�ڷ�Ӧ��ʧȥ���ӣ�Ϊ����������������Ӧ�� ��ȼ�ϵ�ط�Ӧ�У�����·ת��0��2mol����ʱ������0��1mol����������£����Ϊ2��24L��
���㣺Ӱ�컯ѧ��Ӧ���ʵ����أ���ѧ��Ӧ�������仯�����Լ�ȼ�ϵ�صĻ���֪ʶ��

I����֪����ӦH2(g) + Cl2(g) = 2HCl(g) ��H=" ��184" kJ/mol
4HCl(g)+O2(g) 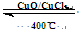 2Cl2(g)+2H2O(g) ��H=" ��115.6" kJ/mol
2Cl2(g)+2H2O(g) ��H=" ��115.6" kJ/mol 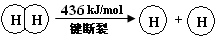
��ش�
��1��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ
��2���Ͽ�1 mol H��O ����������ԼΪ kJ
II����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ��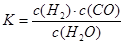 ��������Ӧ�Ļ�ѧ����ʽΪ��
��������Ӧ�Ļ�ѧ����ʽΪ��
��2����֪��400��ʱ��N2 (g)+ 3H2(g)  2NH3(g) ��H<0 ��K=0.5����400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧv(N2)�� v(N2)���������������������ȷ������1�֣�
2NH3(g) ��H<0 ��K=0.5����400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧv(N2)�� v(N2)���������������������ȷ������1�֣�
��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ���1�֣�
A����С�������ѹǿ B�������¶� C���Ӵ��� D��ʹ����Һ������
��3����һ��������ܱ������У��������»�ѧ��Ӧ��A(g) + 3B(g)  2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t/K | 300 | 400 | 500 | �� |
| K/(mol��L��1)2 | 4��106 | 8��107 | K1 | �� |
������������⣺
���жϸ÷�Ӧ�Ħ�H 0���>����<���� ��1�֣�
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬���� ������ţ�
A��3v(B)������=2v(C)������ B��A��B��ת�������
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
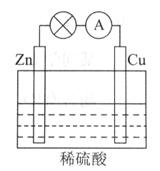
��4������Ȼ��(�������ʲ����뷴Ӧ)Ϊԭ�ϵ�ȼ�ϵ��ʾ��ͼ��ͼ��ʾ��
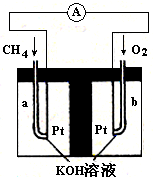
�ٷŵ�ʱ�������ĵ缫��ӦʽΪ
�ڼ���װ����ʢװ100.0 mL 3.0 mol��L��1 KOH��Һ���ŵ�ʱ���뷴Ӧ�������ڱ�״�������Ϊ8 960 mL���ŵ���Ϻ������Һ�и�����Ũ�ȵĴ�С��ϵΪ
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ� ũҵ������������������Ҫ���ã� 
��1����ͼ��N2(g)��H2(g)��Ӧ����1mol NH3(g)�����������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ�� ��
��2������֪�������ݣ�
| ��ѧ�� | H��H | N��N |
| ����/kJ��mol��1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N-H�ļ��� kJ��mol��1��
��3���ϳɰ���Ӧͨ��������ý��������ʹ������ý��E1��E2�ı仯�ǣ�E1 ��E2______��
��H (���������С���������䡱)��
��4����NH3����ԭNOX���������������������Ⱦ������
4NH3(g)+3O2(g)�� 2N2(g)+6H2O(g) ����H1��akJ��mol-1
N2(g)+O2(g)��2NO(g)�� ��H2��bkJ/mol
��1mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�ȡ�H3�� kJ/mol���ú�a��b��ʽ�ӱ�ʾ����
���£��ݻ�Ϊ1 L���������£�����Է�������ת�����䷴Ӧ���̺�������ϵ��ͼ1��ʾ(��֪��2SO2(g)��O2(g) 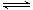 2SO3(g) ��H����196.6 kJ��mol��1)����ش��������⣺
2SO3(g) ��H����196.6 kJ��mol��1)����ش��������⣺
(1)д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ��______________________��
(2)��H2��__________kJ��mol��1��
��.��ҵ�ϳ����ô�����Ҵ��ϳ��л��ܼ�����������
CH3COOH(l)��C2H5OH(l)  CH3COOC2H5(l)��H2O(l) ��H����8.62 kJ��mol��1
CH3COOC2H5(l)��H2O(l) ��H����8.62 kJ��mol��1
��֪CH3COOH��C2H5OH��CH3COOC2H5�ķе�����Ϊ118 �桢78 ���77 �档������������ͬʱ��ij�о�С������˶��ʵ�飬ʵ������ͼ��ʾ��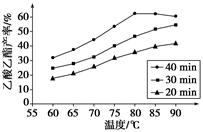
(1)���о�С���ʵ��Ŀ����___________________________________��
(2)60 ���·�Ӧ40 min��70 ���·�Ӧ20 min��ȣ�ǰ�ߵ�ƽ����Ӧ����________����(�С�ڡ��������ڡ����ڡ�)��
(3)��ͼ��ʾ����Ӧʱ��Ϊ40 min���¶ȳ���80 ��ʱ���������������½���ԭ�������_________________________________(д������)��
��.ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⡣
��֪��CO(g)��H2O(g) 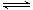 H2(g)��CO2(g)ƽ�ⳣ�����¶ȵı仯���±���
H2(g)��CO2(g)ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
�Իش��������⣺
(1)��800 �淢��������Ӧ���Ա��е����ʵ���Ͷ����ݷ�Ӧ��������������Ӧ�����ƶ�����________(ѡ�A��B��C��D��E��)��
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
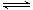 2CO(g)ƽ�ⳣ��ΪK��
2CO(g)ƽ�ⳣ��ΪK����C(s)��H2O(g)
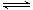 CO(g)��H2(g) ƽ�ⳣ��ΪK1��
CO(g)��H2(g) ƽ�ⳣ��ΪK1����CO(g)��H2O(g)
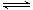 H2(g)��CO2(g) ƽ�ⳣ��ΪK2��
H2(g)��CO2(g) ƽ�ⳣ��ΪK2����K��K1��K2֮��Ĺ�ϵ��______________________________________��
����һ����Ҫ�Ļ�����Ʒ���ǵ��ʹ�ҵ���л��ϳɹ�ҵ�Լ��������ᡢ��κʹ����ԭ�ϣ�Ҳ��һ�ֳ��õ��������
(1) ʵ�����Ʊ������Ļ�ѧ��Ӧ����ʽΪ_________��
(2) ��ҵ�ϳɰ��ķ�Ӧ����ʽΪ��N2(g)��3H2(g) 2NH3(g) ��H����ͼI�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼD�Ǻϳɚݷ�Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
2NH3(g) ��H����ͼI�Ǻϳɰ���Ӧ�������뷴Ӧ�������ͼ��δʹ�ô�������ͼD�Ǻϳɚݷ�Ӧ��2L�����С���ͬͶ������¡���������������ʱ��ijһ��Ӧ�����ĸı�Է�Ӧ��Ӱ��ͼ��
����˵����ȷ����_______��
| A����H����92.4kJ/mol |
| B��ʹ�ô�����ʹE1����ֵ���� |
| C��Ϊ�����ת���ʣ���ҵ�����з�Ӧ��Ũ��Խ��Խ�� |
| D��ͼII�Dz�ͬѹǿ�·�Ӧ��ϵ�а������ʵ����뷴Ӧʱ���ϵͼ����PA<PB |
F.�÷�Ӧ��ƽ㕳���KA<KB
G.������A�����£���Ӧ�ӿ�ʼ��ƽ�⣬����N2��ƽ������Ϊ
 mol/(L��min)
mol/(L��min)(3) �����¶��£���һ���ݻ�Ϊ2 L���ܱ�������ͨ��2 mol N2��7 mol H2���ﵽƽ��ʱ���������ѹǿΪ��ʼʱ��
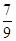 ��������¶��µ�ƽ�ⳣ��Ϊ_______����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�Ϊamol N2 b molH2 c mol NH3 (a,b,c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a,b,c����Ĺ�ϵΪ_____________(�ú�a,b,c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��_______
��������¶��µ�ƽ�ⳣ��Ϊ_______����ͬһ�¶ȣ�ͬһ�����У�����ʼ���ʸ�Ϊamol N2 b molH2 c mol NH3 (a,b,c����Ϊ�㣩��ʹƽ�������и����ʵ�������ԭƽ����ͬ����a,b,c����Ĺ�ϵΪ_____________(�ú�a,b,c�ı���ʽ��ʾ��������ʹ��Ӧ����ʼʱ���淴Ӧ������У�c��ȡֵ��Χ��_______(4)��֪H2(g)��ȼ����Ϊ285.8 kJ/mol����д����ʾNH3(g)ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽ_____������Ϊȼ�Ͽ�������ư�ȼ�ϵ�أ��缫���Ͼ�Ϊ���Ե缫,KOH��Һ���������Һ���õ�ظ����缫��ӦʽΪ_______���y�����õ���������ÿ�ų�1molN2ʵ���ṩ460kJ�ĵ��ܣ����ȼ�ϵ�ص�ʵ��Ч��Ϊ_____(ȼ�ϵ�ص�ʵ��Ч����ָ���ʵ���ṩ�ĵ���ռȼ�ϵ�ط�Ӧ�����ͷų���ȫ�������İٷ���)
 2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��
2SO3(g)��д���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ�� 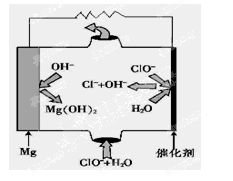
 CH3OH(g)+H2O(g) ��H1 �ش��������⡣
CH3OH(g)+H2O(g) ��H1 �ش��������⡣ CO(g) + 3H2(g)��һ���¶��£���2 mol CH4��4 mol H2Oͨ���ݻ�Ϊ10L���ܱշ�Ӧ���У���Ӧ��CO�����ʵ���Ũ�ȵı仯�����ͼ��ʾ����ش��������⣺
CO(g) + 3H2(g)��һ���¶��£���2 mol CH4��4 mol H2Oͨ���ݻ�Ϊ10L���ܱշ�Ӧ���У���Ӧ��CO�����ʵ���Ũ�ȵı仯�����ͼ��ʾ����ش��������⣺