题目内容
对下列化学用语的理解和描述均正确的是( )
A、电子式  可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
B、比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C、结构示意图为  的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D、原子结构示意图  可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
考点:电子式、化学式或化学符号及名称的综合,原子结构示意图,球棍模型与比例模型
专题:
分析:A.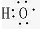 中氧原子最外层7个电子,只能表示羟基,不能表示氢氧根离子;
中氧原子最外层7个电子,只能表示羟基,不能表示氢氧根离子;
B.二氧化碳为直线型结构, 为V型,不能表示二氧化碳的比例模型;
为V型,不能表示二氧化碳的比例模型;
C.如果n=16, 为硫离子,硫离子能够破坏水的电离平衡;
为硫离子,硫离子能够破坏水的电离平衡;
D. 的核电荷数=核外电子数=6,表示所有的C原子.
的核电荷数=核外电子数=6,表示所有的C原子.
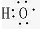 中氧原子最外层7个电子,只能表示羟基,不能表示氢氧根离子;
中氧原子最外层7个电子,只能表示羟基,不能表示氢氧根离子;B.二氧化碳为直线型结构,
 为V型,不能表示二氧化碳的比例模型;
为V型,不能表示二氧化碳的比例模型;C.如果n=16,
 为硫离子,硫离子能够破坏水的电离平衡;
为硫离子,硫离子能够破坏水的电离平衡;D.
 的核电荷数=核外电子数=6,表示所有的C原子.
的核电荷数=核外电子数=6,表示所有的C原子.解答:
解:A.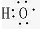 只能表示羟基,不能表示氢氧根离子,氢氧根离子正确的电子式为:
只能表示羟基,不能表示氢氧根离子,氢氧根离子正确的电子式为: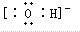 ,故A错误;
,故A错误;
B.二氧化碳分子为直线型结构,二氧化碳的正确的比例模型为 ,故B错误;
,故B错误;
C.结构示意图为 的阴离子中,当n=16时,表示的为硫离子,硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;
的阴离子中,当n=16时,表示的为硫离子,硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;
D.原子结构示意图 为C原子,表示所有的碳原子,既可以表示12C,也可以表示14C,故D正确;
为C原子,表示所有的碳原子,既可以表示12C,也可以表示14C,故D正确;
故选D.
 只能表示羟基,不能表示氢氧根离子,氢氧根离子正确的电子式为:
只能表示羟基,不能表示氢氧根离子,氢氧根离子正确的电子式为: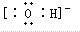 ,故A错误;
,故A错误;B.二氧化碳分子为直线型结构,二氧化碳的正确的比例模型为
 ,故B错误;
,故B错误;C.结构示意图为
 的阴离子中,当n=16时,表示的为硫离子,硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;
的阴离子中,当n=16时,表示的为硫离子,硫离子能够结合水电离的氢离子,破坏了水的电离平衡,故C错误;D.原子结构示意图
 为C原子,表示所有的碳原子,既可以表示12C,也可以表示14C,故D正确;
为C原子,表示所有的碳原子,既可以表示12C,也可以表示14C,故D正确;故选D.
点评:本题考查了电子式、比例模型、原子结构示意图等知识,题目难度中等,注意掌握常见的化学用语的概念及正确的表示方法,明确羟基与氢氧根离子的区别.

练习册系列答案
相关题目
能在水溶液中大量共存的一组离子是( )
| A、ClO-、I-、Na+、SO42- |
| B、Al3+、K+、CO32-、Cl- |
| C、K+、Ag+、Ca2+、NO3- |
| D、NH4+、Na+、OH-、MnO4- |
VLFe2(SO4)3溶液中含有a克SO42-的溶液取0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为( )
| A、a/576V mol?L-1 |
| B、a/125 mol?L-1 |
| C、250a/36V mol?L-1 |
| D、250a/48V mol?L-1 |
设阿伏加德罗常数为NA,标准状况下,m g N2气体含有b个分子,则n g N2在相同状态下的体积为 (单位为L)( )
A、
| ||
B、
| ||
C、
| ||
D、
|
在标准状况下,若VL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
在相同的温度和压强下,下列气体的密度最小的是( )
| A、CO2 |
| B、H2 |
| C、O2 |
| D、Cl2 |
NA表示阿伏加德罗常数值,下列说法正确的是( )
| A、18g水所含电子数为NA |
| B、14g CO和N2的混合气体所含分子数为NA |
| C、16g O2和O3的混合气体所含原子数为NA |
| D、58.5g NaCl所含的离子数为NA |
下列电离方程式不正确的是( )
| A、CaCl2=Ca2++2Cl- |
| B、NaHSO4=Na+H++SO 42- |
| C、HNO3=H++NO 3- |
| D、KHCO3=K++H++CO 32- |