题目内容
【题目】燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。

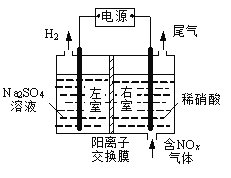
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组om] | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K=________,该反应的ΔH________0 (填“>”或“<”)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则b/a 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V逆 V正(填“<” ,“>” ,“=”)。
④判断该反应达到平衡的依据是________。
A.CO2减少的化学反应速率和CO减少的化学反应速率相等 B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等 D.容器中气体的平均相对分子质量不随时间而变化
【答案】(1)SO2-2e-+2H2O=4H++SO42-
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O ΔH=-(3/2b+2c-a-d)kJ·mol-1
(3) ①1/6(或0.17) ΔH<0 ② >1 ③ > ④ A
【解析】
试题分析:(1)SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+;
(2)已知:①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=--akJmol-1;
CH3OH(g)+H2O(g) △H=--akJmol-1;
②2H2(g)+O2(g)═2H2O(g) △H=--bkJmol-1;
③H2O(g)═H2O(l) △ H=--ckJmol-1;
④CH3OH(g)═CH3OH(l) △H=--dkJmol-1,
根据盖斯定律,将②×3/2+③×2-①-④得:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)
△H=3/2×△H2+2△H3-△H1-△H4=-(3/2b+2c-a-d)kJmol-1,所以CH3OH(l)燃烧热的热化学方程式为
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O ΔH=-(3/2b+2c-a-d)kJ·mol-1;
(3)①实验1中CO的转化率为![]() ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为![]() ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,实验2条件下平衡常数,需要列式计算平衡浓度;
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,实验2条件下平衡常数,需要列式计算平衡浓度;
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol/L) 0.5 1 0 0
转化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.3 0.8 0.2 0.2
K=![]() =
=![]() =0.17;
=0.17;
②根据CO(g)+H2O(g)![]() CO2(g)+H2(g),增大水蒸气的浓度,平衡向正反应方向移动,CO的转化率增大,水蒸气的转化率减小,即a/b<1,则b/a>1;
CO2(g)+H2(g),增大水蒸气的浓度,平衡向正反应方向移动,CO的转化率增大,水蒸气的转化率减小,即a/b<1,则b/a>1;
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,Qc=1>K=0.17,反应向逆反应方向进行,即V正<V逆;
④A、CO2减少的化学反应速率和CO减少的化学反应速率相等,表示V正=V逆,能够判断反应达到了平衡,A正确;B、该反应为气体体积不变的反应,容器内气体压强始终保持不变,不能判断反应达到了平衡,B错误;C、CO、H2O、CO2、H2的浓度都相等,但不一定是不变的,则不能够判断反应达到了平衡,C错误;D、容器内气体的物质的量不变,气体的质量不变,容器中气体的平均相对分子质量始终不变,不能判断反应达到了平衡,D错误;答案选A。