题目内容
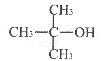
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是

A. BOH属于弱碱
B. BOH的电离常数K=1×10-4.8
C. P点所示的溶液中:c(Cl-)>c(B+)
D. N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
【答案】C
【解析】
A. 若BOH为强碱,其完全电离,那么c(BOH)为0,那么![]() 这样的式子必然不合理。由图中N点的数据可以计算出BOH的电离常数,可以判断BOH为弱碱,A项正确;
这样的式子必然不合理。由图中N点的数据可以计算出BOH的电离常数,可以判断BOH为弱碱,A项正确;
B.BOH B+ + OH-,所以Kb=![]() ,可得
,可得![]() =-lgKb+lgc(OH-)=-lgKb-pOH,带入N点数据,可得0=-lgKb-4.8,Kb=10-4.8,B项正确;
=-lgKb+lgc(OH-)=-lgKb-pOH,带入N点数据,可得0=-lgKb-4.8,Kb=10-4.8,B项正确;
C.根据电荷守恒得c(Cl-)+ c(OH-)=c(B+)+ c(H+),在P点,pOH<7,说明溶液显碱性,c(OH-)> c(H+),因而c(Cl-)<c(B+),C项错误;
D.N点![]() =0,因而c(B+)= c(BOH),根据电荷守恒,c(Cl-)+ c(OH-)=c(B+)+ c(H+),可变为c(Cl-)+ c(OH-)=c(BOH)+ c(H+),因而c(H+)=c(Cl-)+c(OH-)-c(BOH),D项正确。
=0,因而c(B+)= c(BOH),根据电荷守恒,c(Cl-)+ c(OH-)=c(B+)+ c(H+),可变为c(Cl-)+ c(OH-)=c(BOH)+ c(H+),因而c(H+)=c(Cl-)+c(OH-)-c(BOH),D项正确。
故答案选C。

【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是( )
A. x=2.4
B. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
C. K1、K2的关系:K2>K1
D. T1、T2的关系:T1>T2
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
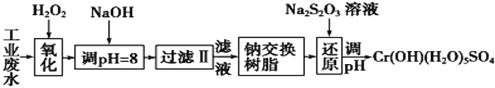
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是____(填序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是____(填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8gCr2O72-转移4.8 mol e-,该反应离子方程式为____。
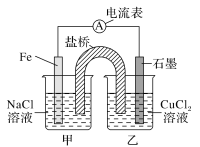
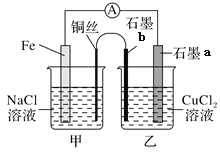
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室用如图装置模拟处理含Cr2O72-废水,阳极反应是Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。
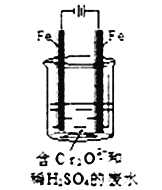
(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________。