题目内容
120°C时,在密闭容器中点燃20.8g甲烷和氧气的混合气,甲烷完全反应后将混合气体依次通过足量的浓硫酸和足量的澄清石灰水,前者增重10.8g(设整个过程中,外界条件保持不变).试通过计算回答:(1)写出该条件下甲烷和氧气反应的化学方程式.
(2)此时在石灰水中生成沉淀的质量是多少?
【答案】分析:(1)根据水的质量可计算甲烷的质量,根据总质量可知氧气的质量,进而判断生成物并书写相关反应的化学方程式;
(2)根据方程式计算生成沉淀的质量.
解答:解:(1)n(H2O)= =0.6mol,
=0.6mol,
则:n(CH4)= ×n(H2O)=
×n(H2O)= ×0.6mol=0.3mol
×0.6mol=0.3mol
m(CH4)=0.3mol×16g/mol=4.8g,
m(O2)=20.8g-4.8g=16g,
n(O2)= =0.5mol,
=0.5mol,
n(CH4):n(O2)=0.3mol:0.5mol=3:5,
则反应的方程式为:3CH4+5O2 CO2+2CO+6H2O,
CO2+2CO+6H2O,
答:该条件下甲烷和氧气反应的化学方程式为3CH4+5O2 CO2+2CO+6H2O.
CO2+2CO+6H2O.
(2)由反应方程式3CH4+5O2 CO2+2CO+6H2O可知,n(CO2)=
CO2+2CO+6H2O可知,n(CO2)= ×n(CH4)=
×n(CH4)= ×0.3mol=0.1mol,
×0.3mol=0.1mol,
则:n(CaCO3)=n(CO2)=0.1mol,
m(CaCO3)=0.1mol×100g/mol=10.0g,
答:在石灰水中生成沉淀的质量是10.0g.
点评:本题考查化学方程式的计算,题目难度不大,注意判断反应的方程式为解答本题的关键.
(2)根据方程式计算生成沉淀的质量.
解答:解:(1)n(H2O)=
 =0.6mol,
=0.6mol,则:n(CH4)=
 ×n(H2O)=
×n(H2O)= ×0.6mol=0.3mol
×0.6mol=0.3molm(CH4)=0.3mol×16g/mol=4.8g,
m(O2)=20.8g-4.8g=16g,
n(O2)=
 =0.5mol,
=0.5mol,n(CH4):n(O2)=0.3mol:0.5mol=3:5,
则反应的方程式为:3CH4+5O2
 CO2+2CO+6H2O,
CO2+2CO+6H2O,答:该条件下甲烷和氧气反应的化学方程式为3CH4+5O2
 CO2+2CO+6H2O.
CO2+2CO+6H2O.(2)由反应方程式3CH4+5O2
 CO2+2CO+6H2O可知,n(CO2)=
CO2+2CO+6H2O可知,n(CO2)= ×n(CH4)=
×n(CH4)= ×0.3mol=0.1mol,
×0.3mol=0.1mol,则:n(CaCO3)=n(CO2)=0.1mol,
m(CaCO3)=0.1mol×100g/mol=10.0g,
答:在石灰水中生成沉淀的质量是10.0g.
点评:本题考查化学方程式的计算,题目难度不大,注意判断反应的方程式为解答本题的关键.

练习册系列答案
相关题目
有关钴和铁化合物的性质见下表:
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl═CoCl2+H2↑工艺流程如下:
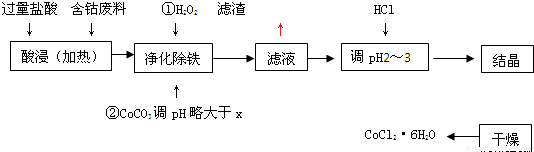
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式______
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全.试计算室温下,Fe(OH)3沉淀完全时,则x=______.
(3)②步中用CoCO3调pH略大于x的原因是______.
(4)滤液中所含溶质有______,______.
(5)为了防止CoCl2?6H2O脱水,“干燥”时宜采用的方法或操作是______,______.
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |

试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式______
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全.试计算室温下,Fe(OH)3沉淀完全时,则x=______.
(3)②步中用CoCO3调pH略大于x的原因是______.
(4)滤液中所含溶质有______,______.
(5)为了防止CoCl2?6H2O脱水,“干燥”时宜采用的方法或操作是______,______.