题目内容
【题目】已知有以下物质相互转化:
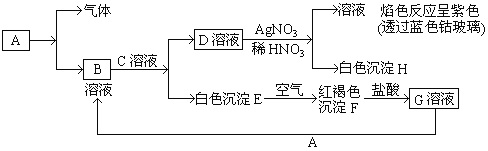
试回答
(1)写出C的化学式____________;
(2)A与水蒸气反应方程式为:__________________________ ;
(3)写出由E转变成F的化学方程式_______________________;
(4)鉴别G溶液中阳离子的方法是:____________________,现象为:________;用G溶液可以腐蚀铜印刷电路板,离子反应方程式为___________________________;
(5)金属铝与A的氧化物可用来焊接火车铁轨,实验室中该反应所需药品有_____________。
【答案】KOH 3Fe+4H2O(g) ![]() Fe3O4+4H2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 取少量G溶液于试管中滴加KSCN溶液 溶液呈红色 2Fe3++Cu=2Fe2++Cu2+ 铝和氧化铁的混合物、氯酸钾和镁条
Fe3O4+4H2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 取少量G溶液于试管中滴加KSCN溶液 溶液呈红色 2Fe3++Cu=2Fe2++Cu2+ 铝和氧化铁的混合物、氯酸钾和镁条
【解析】
通过D与硝酸银反应产物的性质和现象可知D为KCl,红色沉淀F为4Fe(OH)3,则E为Fe(OH)2,G为FeCl3,由此可知A为Fe,B为FeCl2,C应为KOH,结合对应物质的性质和题目要求可解答该题。
根据上述推断可知A是Fe,B是FeCl2,C为KOH,D为KCl,E为Fe(OH)2,F为4Fe(OH)3,G为FeCl3,H为AgCl。
(1)根据上述分析可知C是KOH;
(2) A是Fe,Fe与水蒸气在高温下反应产生Fe3O4和H2,反应方程式为3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
(3) Fe(OH)2不稳定,在空气中容易被空气中的氧气氧化为Fe(OH)3,由E转变成F的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)G为FeCl3,其阳离子为Fe3+,鉴别G溶液中阳离子Fe3+的方法是取少量G溶液于试管中滴加KSCN溶液,若溶液变为血红色,就证明含有Fe3+;Fe3+具有强的氧化性,可以与Cu发生氧化还原反应,离子反应方程式为2Fe3++Cu=2Fe2++Cu2+,一次工业上用FeCl3溶液来腐蚀铜印刷电路板;
(5)由于Al的活动性强,可以把金属从其氧化物置换出来,所以金属铝与铁的氧化物在高温下发生铝热反应置换的铁用来焊接火车铁轨。实验室中该反应所需药品有氧化剂氯酸钾、引燃剂镁条、铝粉和活动性比铝弱的金属铁的氧化物—氧化铁。