题目内容
【题目】(1)已知下列两个反应:①Fe+H2SO4(稀)=FeSO4+H2![]() ;②Cu+2H2SO4(浓)=CuSO4+SO2
;②Cu+2H2SO4(浓)=CuSO4+SO2![]() +2H2O。试回答下列问题:
+2H2O。试回答下列问题:
(1)反应①中_______元素被还原,反应②中_______元素被还原.(填元素符号)
(2)当反应①生成2gH2时,消耗H2SO4的质量是_______克。
(3)反应②中生成32gSO2气体时,转移_______mol电子。
(4)图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):
A_________;B_________;C_________;D_________;E__________.
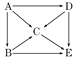
【答案】 H S 98 1mol。 Na Na2O NaOH Na2O2 Na2CO3
【解析】(1)反应①中H元素化合价降低,H元素被还原;反应②中S元素化合价降低,S元素被还原;(2)当反应①生成2gH2时,氢气的物质的量是1mol,则根据方程式可知消耗H2SO4的物质的量是1mol,质量是98克。(3)反应②中生成32gSO2气体时,二氧化硫的物质的量是32g÷64g/mol=0.5mol,S元素化合价从+6价降低到+4价,因此转移0.5mol×2=1mol电子。(4)若将它们灼烧,火焰都呈黄色,说明均含有钠元素;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源,D是过氧化钠,所以A是钠,B是氧化钠,C是氢氧化钠,E是碳酸钠,则A~E各物质的化学式分别是Na、Na2O、NaOH、Na2O2、Na2CO3。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目

