题目内容
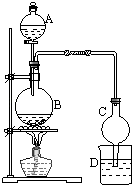
【题目】某化学小组利用如图装置进行某些气体的制备和性质实验,图中加持装置有省略
(1)为制取干燥氨气,可将装置C与装置D连接,则装置D中 的固体宜选用a.碱石灰 b.无水氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净干燥的氯气,则两个E装置内的药品依次是
(3)装置F可用于探究氯气和氨气反应,实验室打开开关1、3,关闭2,先向烧瓶中通入 , 然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体.实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 .
(4)利用装置A、E,可设计实验比较氯离子和溴离子的还原性强弱,能证明结论的实验现象是 . 若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是 .
(5)将装置B、C分别于F相连后,进行硫化氢和二氧化硫反应的实验,烧杯中的试剂所起的作用是 .
【答案】
(1)ad
(2)饱和食盐水、浓硫酸
(3)氯气;取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+
(4)装置E中的NaBr溶液变橙红色;将分液漏斗改为温度计,并使温度计水银球没入烧瓶内液面下
(5)证明烧瓶中压强减少,同时吸收剩余气体二氧化硫或硫化氢有毒气体
【解析】解:Ⅰ、(1)实验中干燥氨气可以用碱石灰或生石灰,故选ad;(2)依据制备氯气装置是利用二氧化锰和浓盐酸加热反应,生成的氯气中含有氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;所以答案是:饱和食盐水、浓硫酸;(3)实验时打开开关1、3,关闭2向烧瓶中通入氯气,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的氨气,实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,已知氯气与氨气可发生反应:3Cl2+2NH3→N2+6HCl,依据反应化学方程式判断是生成的氯化氢和过量氨气反应生成的氯化铵;铵根离子的检验方法是,取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;所以答案是:氯气;取少量固体于试管中,加入适量NaOH溶液并加热,在管口用湿润的红色石蕊试纸检验产生的气体,若湿润的红色石蕊试纸变蓝,证明固体中有NH4+;(4)利用装置A、E,可设计实验比较Cl﹣和Br﹣的还原性强弱,氯气通入溴化钠溶液中,氯气氧化溴离子为溴单质,反应为:Cl2+2NaBr=Br2+2NaCl,溴单质溶于水溶液呈橙红色;若利用装置A、E进行乙烯与溴水反应的实验,装置A是乙烯制备装置,需要控制反应温度170°C,实验装置中需要用温度计控制反应液的温度,所以要将分液漏斗改为温度计,并使温度计水银球没入烧瓶内液面下;所以答案是:装置E中的NaBr溶液变橙红色;将分液漏斗改为温度计,并使温度计水银球没入烧瓶内液面下;(5)将装置B、C分别与F相连后,进行H2S与SO2反应的实验,B是制备硫化氢气体的发生装置,C是二氧化硫气体制备的装置,通入F中二氧化硫氧化硫化氢生成硫单质,容器中压强减小,会产生倒吸,同时F烧杯可以吸收剩余气体二氧化硫或硫化氢有毒气体;所以答案是:证明烧瓶中压强减少,同时吸收剩余气体二氧化硫或硫化氢有毒气体.

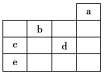
【题目】下表是元素周期表的一部分,请按要求回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | … | |||||||
2 | … | ② | ③ | ④ | |||||
3 | ⑤ | … | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | … | ⑩ |
(1)④、⑤、⑥的原子半径由大到小的顺序是________(用元素符号表示)
(2)②、⑦两种元素最高价氧化物对应的水化物中酸性最强的是 ______(用化学名称表示),能证明以上结论的化学方程式是 ______________________________________
(3)第三周期元素形成的简单离子中半径最小的微粒是_____(用离子符号表示),写出⑥元素的单质与⑤最高价氧化物对应的水化物反应的离子方程式____________________。
(4)元素③、⑧的氢化物中,沸点较低的物质的结构式是_____; 请简述理由_______________。
(5)①、③、④、⑥元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。用电子式表示下列4种微粒。
A________、B________、C________、D________。
(6)⑨元素与⑩元素两者核电荷数之差是 ____________ 。